ĪĪĪĪĪĪ ĪĪĪĪ
ĪĪĪĪĪĪ ĪĪĪĪ
ĪĪĪĪĪĪ ĪĪĪĪ
ĪĪĪĪĪĪ ĪĪĪĪ
ĪĪĪĪĪĪ ĪĪĪĪ
ĪĪĪĪĪĪ ĪĪĪĪ
ĪĪĪĪĪĪ ĪĪĪĪ
ĪĪĪĪĪĪ ĪĪĪĪ
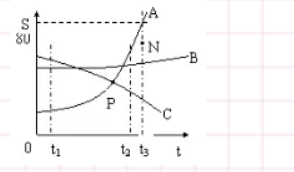
- ųą┐╝ėóšZū„╬─
- įćŅ}Ż║ ėóšZšµŅ} ŠÜ┴ĢŅ} į┬┐╝ Ų┌ųą Ų┌─®
- ų¬ūR³cŻ║┐╝³cĘų╬÷ ▒╗äėšZæB(t©żi) Šõą═ĮYśŗ ┘ešZÅ─Šõ ¼F(xi©żn)į┌▀MąąĢr
ĪĪĪĪĪĪ ĪĪĪĪ
ĪĪĪĪĪĪ ĪĪĪĪ
ĪĪĪĪĪĪ ĪĪĪĪ
ĪĪĪĪĪĪ ĪĪĪĪ
ĪĪĪĪĪĪ ĪĪĪĪ