Т»ЎўОпЩ|өДҷzтһ
АыУГОпЩ|МШУРөДРФЩ|��Ј¬ҙ_¶ЁОпЩ|КЗ·сҙжФЪөДҢҚтһ·Ҫ·ЁЎЈ1���ЎўСхҡвЈәҺ§»рРЗөДДҫ—l·ЕИлЖҝЦРЈ¬ИфДҫ—lҸНИј�Ј¬„tКЗСхҡвЎЈ2���ЎўҡдҡвЈәФЪІЈБ§јвЧмьcИјҡвуw���Ј¬ХЦТ»ёЙАдРЎҹэұӯЈ¬У^ІмұӯұЪКЗ·сУРЛ®өО���Ј¬НщҹэұӯЦРө№ИліОЗеөДКҜ»ТЛ®��Ј¬ИфІ»ЧғңҶқб�Ј¬„tКЗҡдҡв�ЎЈ3��Ўў¶юСх»ҜМјЈәНЁИліОЗеөДКҜ»ТЛ®�����Ј¬,ИфЧғңҶқб„tКЗ¶юСх»ҜМј��ЎЈ4��Ўў°ұҡвЈәқсқҷөДЧПјtЙ«КҜИпФҮјҲ����Ј¬ИфФҮјҲЧғЛ{,„tКЗ°ұҡв����ЎЈ5ЎўЛ®ХфҡвЈәНЁЯ^ҹoЛ®БтЛбг~��Ј¬Иф°ЧЙ«№МуwЧғЛ{,„tә¬Л®Хфҡв���ЎЈ
ЈЁ¶юЈ©�ЎўлxЧУөДҷzтһ
6�ЎўҡдлxЧУЈәөОјУЧПЙ«КҜИпФҮТә/јУИлд\БЈЎЈ7ЎўҡдСхёщлxЧУЈә·УМӘФҮТә/БтЛбг~ИЬТә�ЎЈ8ЎўМјЛбёщлxЧУЈәПЎы}ЛбәНіОЗеөДКҜ»ТЛ®�����ЎЈ9�ЎўВИлxЧУЈәПхЛбгyИЬТәәНПЎПхЛб�Ј¬Иф®aЙъ°ЧЙ«іБөн,„tКЗВИлxЧУЎЈ10��ЎўБтЛбёщлxЧУЈәПхЛбд^ИЬТәәНПЎПхЛб/ПИөОјУПЎы}ЛбФЩөОИлВИ»Ҝд^��ЎЈ11�����Ўўд@ёщлxЧУЈәҡдСх»ҜвcИЬТәІўјУҹб��Ј¬°СқсқҷөДјtЙ«КҜИпФҮјҲ·ЕФЪФҮ№ЬҝЪ��ЎЈ12�����Ўўг~лxЧУЈәөОјУҡдСх»ҜвcИЬТәЈ¬Иф®aЙъЛ{Й«іБөн„tКЗг~лxЧУ�����ЎЈ13����ЎўиFлxЧУЈәөОјУҡдСх»ҜвcИЬТәЈ¬Иф®aЙъјtәЦЙ«іБөн„tКЗиFлxЧУ�ЎЈ
¶юЎўОпЩ|өДіэлs
ёщ“юОпЩ|әНлsЩ|өДОпАн»ҜҢWРФЩ|��Ј¬ІЙУГЯm®”?shЁҙ)Д·Ҫ·Ё°С»мәПОпЦРлsЩ|·ЦлxіэИҘ��Ј¬ҸД¶шөГөҪјғғфөДДіОпЩ|өДҢҚтһ·Ҫ·Ё�ЎЈ1ЎўЯ^һV·ЁЈәЯmУГУЪІ»ИЬУЪТәуwөД№МуwЕcТәуwөД·Цлx»тМбјғ��ЎЈ2�ЎўҪYҫ§·ЁЈәЯmУГУЪҝЙИЬРФ№МуwЕcТәуwөД·ЦлxәНМбјғЎЈҫЯуw·Ҫ·ЁУРғЙ·N���ЎЈўЩ ҪөңШҪYҫ§·ЁЈәЯmУГУЪИЬҪв¶ИКЬңШ¶ИЧғ»ҜУ°н‘Э^ҙуөД№М‘B(tЁӨi)ОпЩ|өД·Цлx»тМбјғ�����ЎЈўЪ Хф°l(fЁЎ)ҪYҫ§·ЁЈәЯmУГУЪИЬҪв¶ИКЬңШ¶ИЧғ»ҜУ°н‘І»ҙу№МуwОпЩ|өД·Цлx»тМбјғ�ЎЈ
ЈЁ¶юЈ©Ўў»ҜҢW·Ҫ·ЁЈә
1����Ўў Фӯ„tЈәўЩ“І»ФцЎўІ»ңp��ЎўТЧ·Ц”ЈәІ»ФцјҙЧоҪKІ»ДЬТэИлРВөДлsЩ|;І»ңpКЗіэлsҪY№ыІ»‘ӘК№ЛщРиОпЩ|ңpЙЩ;ТЧ·ЦКЗјУИлФҮ„©әу��Ј¬К№лsЩ|ЮD»ҜһйіБөн��ЎўҡвуwәНЛ®өИЕcЛщРиОпЩ|ТЧУЪ·Цлx��ЎЈўЪПИіэлsәуёЙФп���ЎЈ2Ўў ·Ҫ·ЁЈә(ТФПВАЁМ–АпөДҫщһйлsЩ|)ўЩ ОьКХ·ЁЈәИзТ»Сх»ҜМј»мУР¶юСх»ҜМјҝЙУГҡдСх»ҜвcөИүAРФИЬТәОьКХ;ўЪ іБөн·ЁЈәИзВИ»ҜвӣЦР»мУРВИ»ҜжVҝЙјУҡдСх»ҜвӣИЬТә�Ј¬ФЩЯ^һV;ўЫ ИЬҪв·ЁЈәИзг~ЦР»мУРСх»Ҝг~ҝЙјУИлЯ^БҝөДы}ЛбЈ¬ФЩЯ^һV;ўЬ ЮD»Ҝ·ЁЈәИзг~ЦР»мУРд\ҝЙјУБтЛбг~ИЬТәФЩЯ^һV;ўЭ ҡв»Ҝ·ЁЈәИзВИ»ҜвcЦР»мУРМјЛбвcҝЙјУИлЯ^Бҝы}Лб���Ј¬ФЩХф°l(fЁЎ)ҪYҫ§;ўЮ јУҹб·ЁЈәИзСх»Ҝв}ЦР»мУРМјЛбв}ҝЙёЯңШЧЖҹэ;ўЯ ҫCәП·ЁЈә®”ә¬УР¶а·NіЙ·ЦөДлsЩ|•r��Ј¬·ЦлxМбјғНщНщІ»ғHғHК№УГТ»·N·Ҫ·Ё����Ј¬¶шКЗҺЧ·N·Ҫ·ЁҪ»МжК№УГЎЈ
ЈЁИэЈ©��ЎўіЈТҠОпЩ|өДіэлs·Ҫ·Ё
1���ЎўCO2(CO)Јә°СҡвуwНЁЯ^ЧЖҹбөДСх»Ҝг~2�ЎўCO(CO2)ЈәНЁЯ^ЧгБҝөДҡдСх»ҜвcИЬТә3��ЎўH2(Л®Хфҡв)ЈәНЁЯ^қвБтЛб/НЁЯ^ҡдСх»Ҝвc№Муw4��ЎўCuO(Cu):ФЪҝХҡвЦР(ФЪСхҡвБчЦР)ЧЖҹэ»мәПОп5����ЎўCu(Fe):јУИлЧгБҝөДПЎБтЛб6ЎўCu(CuO):јУИлЧгБҝөДПЎБтЛб7�����ЎўFeSO4(CuSO4):јУИлЧгБҝөДиF·Ы8�ЎўNaCl(Na2CO3):јУИлЧгБҝөДы}Лб9ЎўNaCl(Na2SO4):јУИлЧгБҝөДВИ»Ҝд^ИЬТә10�ЎўNaCl(NaOH):јУИлЧгБҝөДы}Лб11ЎўNaOH(Na2CO3)ЈәјУИлЧгБҝөДҡдСх»Ҝв}ИЬТә12���ЎўNaCl(CuSO4)ЈәјУИлЧгБҝөДҡдСх»Ҝд^ИЬТә13�ЎўNaNO3(NaCl):јУИлЧгБҝөДПхЛбгyИЬТә14ЎўNaCl(KNO3):Хф°l(fЁЎ)ИЬ„©15�ЎўKNO3(NaCl)ЈәАд…sҹбп–әНИЬТә.16ЎўCO2(Л®Хфҡв)ЈәНЁЯ^қвБтЛб.
Иэ�Ўў·Ҫ·ЁАэОц
Ифҡв‘B(tЁӨi)»мәПОпЦРөДлsЩ|ҡвуwДЬүтұ»Ді·NФҮ„©ОьКХЈ¬„tҝЙІЙУГОьКХ·Ёіэлs����ЎЈЧҢҡвуw»мәПОпНЁЯ^КўУРДі·NФҮ„©өДПҙҡвЖҝәујҙҝЙөГөҪјғғфОпЎЈАэ1 ИфCOЦР»мУРЙЩБҝCO2���Ј¬УыіэИҘCO2Ңў»мәПҡвуwНЁЯ^( )ИЬТәЎЈ·ЦОцЈәCO2КЗЛбРФСх»ҜОп���Ј¬ЛбРФСх»ҜОпДЬёъүA·ҙ‘ӘЙъіЙы}әНЛ®���Ј¬¶шCOІ»ДЬИЬУЪЛ®ТІІ»ёъүA·ҙ‘ӘЎЈЛщТФҝЙЧҢ»мәПҡвуwНЁЯ^КҜ»ТЛ®»тҡдСх»ҜвcИЬТә����ЎЈ
ЈЁ¶юЈ©ЎўіБөн·Ё
Нщ»мәПИЬТә(Иф»мәПОпһй№М‘B(tЁӨi)�Ј¬„t‘ӘПИЦЖіЙИЬТә)ЦРјУИлДі·NФҮ„©����Ј¬К№ЖдЦРлsЩ|НЁЯ^·ҙ‘ӘТФіБөнОціц����Ј¬И»әуҪӣЯ^һVіэИҘіБөнЈ¬өГөҪјғғфОпөДИЬТә�ЎЈАэ2 ТӘіэИҘВИ»ҜвcЦРә¬УРЙЩБҝБтЛбиFлsЩ|Ј¬‘ӘЯxУГөДТ»·NФҮ„©КЗ( )A.ВИ»ҜвcИЬТәB.ҡдСх»Ҝд^ИЬТәC.МјЛбвcИЬТәD.ҡдСх»ҜвӣИЬТә·ЦОцЈәұҫо}Ц»ДЬЯxјУҡдСх»Ҝд^ИЬТә��Ј¬ёъБтЛбиF°l(fЁЎ)ЙъҸН·ЦҪв·ҙ‘Ә�Ј¬ЙъіЙБтЛбд^әНҡдСх»ҜиFіБөнЎЈө«ИфЯxЖдУаОпЩ|�Ј¬ҫщТЧФЪіэлsЯ^іМЦРТэИлРВөДлsЩ|ЎЈ
ЈЁИэЈ©����Ўўҡв»Ҝ·Ё
НЁЯ^°С»мәПОпјУҹб»тјУИлФҮ„©Ј¬К№ЖдЦРлsЩ|°l(fЁЎ)Йъ»ҜҢW·ҙ‘Ә��Ј¬ЧғіЙҡвуw¶шТЭіц���ЎЈАэ3 іэөфВИ»ҜвcИЬТәЦР»мУРөДЙЩБҝМјЛбвc��Ј¬‘ӘЯxУГЯmБҝөДФҮ„©КЗ( )A.ПЎБтЛбB.ПхЛбгyC.іОЗеКҜ»ТЛ®D.ПЎы}Лб·ЦОцЈәұҫо}іэИҘлsЩ|МјЛбвc����Ј¬ҝЙҝј‘]јУИлЛбИЬТәЕcМјЛбвc°l(fЁЎ)ЙъҸН·ЦҪв·ҙ‘ӘЈ¬°СлsЩ|ЧғіЙCO2ҡвуwТЭіц���ЎЈө«ТӘЧўТвјУИлөДЛбЦ»ДЬКЗы}Лб����Ј¬·с„tУЦ•ю®aЙъРВөДвcы}лsЩ|���ЎЈ
ЈЁЛДЈ©�����ЎўЮD»Ҝ·Ё
НЁЯ^Яm®”?shЁҙ)Д·Ҫ·Ё����Ј¬°СУыіэИҘөДлsЩ|ЮDЧғ?yЁӯu)йјғғфОп����Ј¬Я@ҳУІ»ғHіэБЛлsЩ|�Ј¬ЗТФцјУБЛјғғфОпөДБҝЈ¬ҝЙЦ^Т»ЕeғЙөГ�Ј¬ТтҙЛКЗЦT¶а·Ҫ·ЁЦРөДЧојС·Ҫ·Ё��ЎЈАэ4 УыіэИҘKNO3ИЬТәАпөДKOHлsЩ|�Ј¬ҝЙјУИлЯmБҝөД_____ИЬТә���Ј¬УРкP·ҙ‘ӘөД»ҜҢW·ҪіМКҪһй______�����ЎЈ·ЦОцЈәіэИҘПхЛбвӣЦР»мУРKOHлsЩ|����Ј¬ҢҚЩ|ЙПКЗіэИҘOH-лxЧУ���Ј¬ЛщТФҝЙЯxјУЛбИЬТә���Ј¬ЕcЦ®°l(fЁЎ)ЙъЦРәН·ҙ‘ӘЈ¬јҙҝЙ°СлsЩ|Чғ?yЁӯu)йПхЛбвӣ����Ј¬ө«Ц»ДЬЯxУГПхЛб��Ј¬¶шІ»ДЬУГЖдЛьЛб�Ј¬·с„t�Ј¬іэИҘБЛOH-Ј¬…sТэЯMБЛРВөДлsЩ|��ЎЈ
ЈЁОеЈ©��ЎўИЬҪв·Ё
АыУГ»мәПОпёчіЙ·ЦФЪДі·NЛб���ЎўүA»ты}ИЬТә°l(fЁЎ)Йъ·ҙ‘ӘөДІ»Н¬ТҺ(guЁ©)ВЙ��Ј¬К№ЛщјУФҮ„©ёълsЩ|°l(fЁЎ)Йъ·ҙ‘Ә�Ј¬ҸД¶шҢўлsЩ|іэИҘ»тЮDЧғ?yЁӯu)йјғғфОп�ЎЈА? ТӘіэИҘәуЯ…АЁМ–ЦРөДлsЩ|Ј¬МоҢ‘ЯxУГФҮ„©өД·ЦЧУКҪЈәCu(Zn)·ЦОцЈәҝЙёщ“юCuәНZnҪрҢЩ»о„УРФөДІ»Н¬��Ј¬CuІ»ёъЛбИЬТә·ҙ‘Ә��Ј¬¶шZnДЬИЬУЪЛб�Ј¬№КҝЙјУИлы}ЛбЕcПЎБтЛбЎЈУЦТтһйд\ұИг~»оқҠ����Ј¬№КТІҝЙјУИлг~ы}ИЬТә�����Ј¬ТІҝЙК№д\ЦГ“Qіцг~¶шИЬҪвЎЈ
ЛД�����Ўўм–№МҫҡБ•
1��ЎўҷzтһNaOHКЗ·сЧғЩ|өД·Ҫ·ЁКЗЈәөОјУПЎы}Лб���Ј¬Иф®aЙъҡвЕЭ„tЧғЩ|��ЎЈ
2�����ЎўҷzтһЙъКҜ»ТЦРКЗ·сә¬УРКҜ»ТКҜЈәөОјУПЎы}Лб����Ј¬Иф®aЙъҡвЕЭ„tә¬УРКҜ»ТКҜ��ЎЈ
3���ЎўҷzтһNaOHЦРКЗ·сә¬УРNaClЈәПИөОјУЧгБҝПЎПхЛб��Ј¬ФЩөОјУAgNO3ИЬТә��Ј¬Иф®aЙъ°ЧЙ«іБөн�����Ј¬„tә¬УРNaCl����ЎЈ
4ЎўҷzтһИэЖҝФҮТә·Ц„eКЗПЎHNO3,ПЎHCl,ПЎH2SO4?ПтИэЦ»ФҮ№ЬЦР·Ц„eөОјУBa(NO3)2ИЬТә�Ј¬Иф®aЙъ°ЧЙ«іБөнЈ¬„tКЗПЎH2SO4;ФЩ·Ц„eөОјУAgNO3ИЬТә����Ј¬Иф®aЙъ°ЧЙ«іБөн„tКЗПЎHClЈ¬КЈПВөДКЗПЎHNO3
5��ЎўҷzтһДіОпЦРКЗ·сә¬УРөн·ЫЈәјУИлөвИЬТә�����Ј¬ИфЧғЛ{„tә¬өн·Ы�ЎЈ
6ЎўҷzтһДіОпЦРКЗ·сә¬УРЖПМСМЗЈәјУИлРВЦЖөДҡдСх»Ҝг~���Ј¬ИфЙъіЙҙuјtЙ«өДСх»ҜҒҶг~іБөн�����Ј¬ҫНә¬ЖПМСМЗ�����ЎЈ
7��ЎўУРИэЖҝҹoЙ«ҹoО¶өДҡвуw�Ј¬·Ц„eКЗСхҡв���ЎўҝХҡв��Ўў¶юСх»ҜМј��Ј¬…^(qЁұ)„eЛьӮғЧоәҶҶОөД·Ҫ·ЁКЗ(ЎЎЎЎ)�ЎЈA.·Ц„eңy¶ЁҡвуwөДГЬ¶ИB.·Ц„eЙмИлИјЦшөДДҫ—lC.·Ц„eөОИліОЗеКҜ»ТЛ®�Ј¬ХсКҺD.·Ц„eөОИлЧПЙ«КҜИпФҮТәЈ¬ХсКҺ
8���ЎўПВБРХf·ЁХэҙ_өДКЗ(ЎЎЎЎ)�ЎЈA.УГЛ®…^(qЁұ)„eNaOHЎўNa2CO3ғЙ·N№МуwB.іэИҘNaClЦРөДCa2+әНSO42-��Ј¬ҝЙТФПИјУИлЯ^БҝөДNa2CO3�Ј¬ФЩјУИлЯ^БҝөДBaCl2C.УГПЎБтЛбіэИҘCa(OH)2ЦРөДCaCO3D.ҝЙТФУГьcИјөД·Ҫ·ЁіэИҘCO2ЦРөДCO
9Ўў…^(qЁұ)„eПВБРёчҪMОпЩ|өД·Ҫ·ЁҝЙРРөДКЗ(ЎЎЎЎ)���ЎЈA.УГы}Лб…^(qЁұ)„eіОЗеКҜ»ТЛ®әНҡдСх»ҜвcПЎИЬТәB.УГ¶юСх»Ҝеi…^(qЁұ)„eЯ^Сх»ҜҡдИЬТәәНјғЛ®C.УГХфрsЛ®…^(qЁұ)„eЛДСх»ҜИэиF·ЫД©әНиF·ЫD.УГг~Ж¬…^(qЁұ)„eПЎы}ЛбәНПЎБтЛб
10����ЎўПВБР…^(qЁұ)·ЦОпЩ|өДФҮ„©»т·Ҫ·ЁеeХ`өДКЗ(ЎЎЎЎ)����ЎЈA.УГВ„ҡвО¶өД·Ҫ·Ё…^(qЁұ)·ЦҫЖҫ«әНКіҙЧB.УГҺ§»рРЗөДДҫ—l…^(qЁұ)·ЦСхҡвәН¶юСх»ҜМјC.УГЛ®…^(qЁұ)·ЦПхЛбд@әНЙъКҜ»ТD.УГ·УМӘИЬТә…^(qЁұ)·ЦБтЛбәНВИ»ҜвcИЬТә
11ЎўТӘіэИҘFeSO4ИЬТәЦРЙЩБҝөДH2SO4�Ј¬ҝЙјУИлөДОпЩ|КЗ(ЎЎЎЎ)ЎЈўЩиF·Ы;ўЪЛДСх»ҜИэиF;ўЫСх»ҜиF;ўЬСх»ҜҒҶиF;ўЭҡдСх»ҜҒҶиF���ЎЈA.ўЪўЫўЭ B.ўЩўЬўЭC.ўЪўЫўЬ D.ўЩўЪўЫ
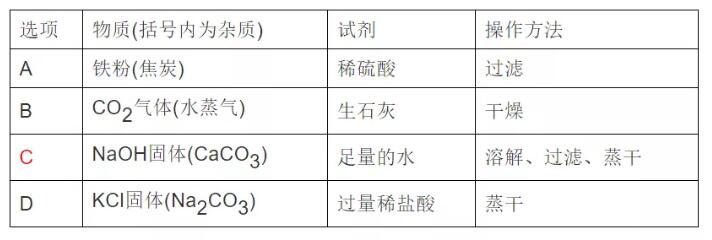
12��ЎўіэИҘПВБРОпЩ|ЦРөДЙЩБҝлsЩ|�����ЎЈЛщЯxУГөДФҮ„©ј°ІЩЧч·Ҫ·ЁҫщХэҙ_өДКЗ(ЎЎЎЎ)�����ЎЈ
13���ЎўВИ»ҜвcКЗТ»·NЦШТӘөДы}Ј¬ТІКЗИЛЙъАн»о„УұШРиөДОпЩ|��Ј¬ёщ“юЛщҢWЦӘЧR»ШҙрЈә

(1)ТӘҷzтһЙъАны}Л®ЦРөДВИ»Ҝвc����Ј¬‘ӘЯxУГөДФҮ„©КЗ__________ИЬТә(Мо»ҜҢWКҪ)ЎЈ(2)іэИҘҙЦы}ЦРДаЙіөИІ»ИЬРФлsЩ|өДІЩЧчЯ^іМһйИЬҪв���Ўў__________әНХф°l(fЁЎ)����ЎЈ(3)ҝЙУГNaOHіэИҘҙЦы}ЦРҝЙИЬРФлsЩ|MgCl2�Ј¬·ҙ‘ӘөД»ҜҢW·ҪіМКҪһйЈә__ЎЈ(4)ИзЙПҲDһйТ»Р©ОпЩ|өДИЬҪв¶ИЗъҫҖ����Ј¬ЖдЦРВИ»ҜвcөДИЬҪв¶ИЗъҫҖөДМШьcКЗ__;ІЙУГАд…sҪYҫ§өД·Ҫ·ЁЈ¬ДЬҸДВИ»Ҝвc»мәПИЬТәЦР·ЦлxіцҒнөДОпЩ|__________(ҸДУТҲDөДОпЩ|ЦРЯxМо)�ЎЈҙр°ёЈә(1)AgNO3(2)Я^һV(3)MgCl2+2NaOH===Mg(OH)2↓+2NaCl
(4)ВИ»ҜвcөДИЬҪв¶ИКЬңШ¶ИУ°н‘Чғ»ҜәЬРЎЎЎПхЛбвӣ
ЎЎЎЎ ҡgУӯК№УГКЦҷC��ЎўЖҪ°еөИТЖ„УФOӮдФLҶ–ЦРҝјҫW���Ј¬2023ЦРҝјТ»В·Ег°йН¬РРЈЎ>>ьc“фІйҝҙ











