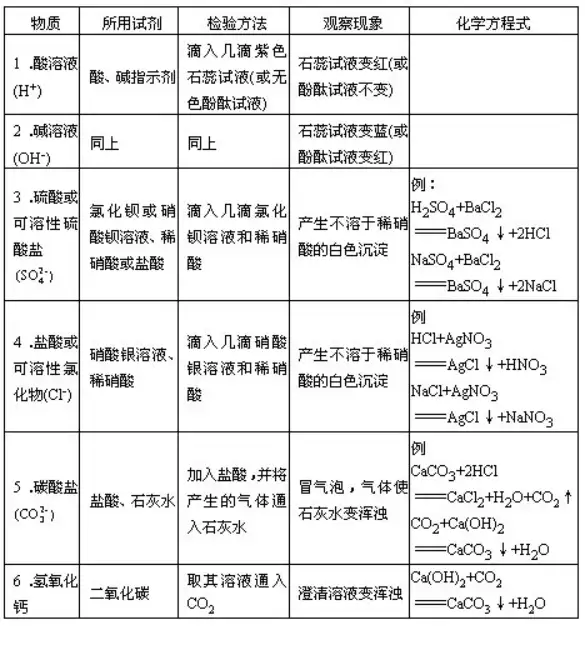
“ΜΓđ艔’ΤΈ’≥Θ”ΟΜ·¨W(xu®Π)ÉxΤς?
ΉωΜ·¨W(xu®Π)¨çρûκx≤Μι_ Ι”ΟΜ·¨W(xu®Π)ÉxΤςΘ§‘Ύ≥θ÷–Μ·¨W(xu®Π)÷–≥Θ Ι”ΟΒΡÉxΤςΦsΕΰ °ΖN���ΓΘΏ@–©ÉxΤς≤ΜΆ§”Ύ»’≥Θ…ζΜν”ΟΨΏΘ§”–ΥϋΉ‘ΦΚΒΡΟϊΖQΚΆΧΊΕ®ΒΡ Ι”ΟΖΫΖ®��ΓΘ Ήœ»ëΣ(y®©ng)‘™’ΐ¥_ΒΊΫ–≥ωΜ·¨W(xu®Π)ÉxΤςΒΡΟϊΖQΘ§≤ΜΡή”Ο…ζΜν”ΟΨΏΒΡΟϊΖQ¥ζΧφΥϋ���ΓΘάΐ»γ���Θ§”–ΒΡ¨W(xu®Π)…ζΑ―üΐ±≠Ϋ–≤ΘΝß±≠ΓΔΑ―‘΅ΙήäAΫ–äAΉ”���Θ§ « °Ζ÷εe’`ΒΡ����ΓΘ
ΗςΖNΜ·¨W(xu®Π)ÉxΤςΕΦ”–“ΜΕ®ΒΡ Ι”ΟΖΕ΅ζ����ΓΘ”–ΒΡ≤ΘΝßÉxΤςΩ…“‘Φ”üα”ΟΘ§»γ‘΅Ιή��ΓΔüΐ±≠�����ΓΔüΐΤΩ�����ΓΔ’τΑl(f®Γ)ΟσΒ»;”–ΒΡ≤ΜΡήΦ”üα����Θ§»γΝΩΆ≤ΓΔΦ·öβΤΩ��ΓΔΥ°≤έΒ»�����ΓΘ”–ΒΡÉxΤςΩ…“‘ΉωΝΩΨΏ”Ο���Θ§»γΆ–±PΧλΤΫΚΆΖ®¥a”Ο¹μΖQ»ΓΈοΌ|(zh®§)ΒΡΌ|(zh®§)ΝΩ;ΝΩΆ≤ΚΆΒΈΕ®Ιή”Ο¹μΝΩ»Γ“ΚσwΒΡσwΖe���ΓΘ”–ΒΡÉxΤς‘Ύ¨çρû―b÷Ο÷–Τπ÷ß™ΈΉς”ΟΘ§»γηFΦή≈_ΦΑΤδΗΫΦΰ”Ο¹μ÷ß™ΈüΐΤΩ��ΓΔüΐ±≠;»ΐΡ_ΦήΦΑΤδΗΫΦΰ”Ο¹μ÷ß™Έüΐ±≠��ΓΔ’τΑl(f®Γ)Οσ���ΓΔέαàεΒ»��ΓΘ”––©ÉxΤςΆβ”^ΚήœύΥΤ���Θ§»ί“ΉΜλœΐ���Θ§ëΣ(y®©ng)‘™Ά®Ώ^¨Π±»Φ”“‘Ζ÷όpΓΘ»γέαàεΚΆ’τΑl(f®Γ)Οσ��Θ§÷–¨W(xu®Π)¨çρû “≥Θ“äûι¥…÷ΤΒΡ���Θ§Άβ”^œύΥΤ����ΓΘέαàεΗΫ”–έαàε…w���Θ§’τΑl(f®Γ)Οσ¦]”–…w;έαàε…œΕΥ¦]”–Νς“Κσw”ΟΒΡΜμΩΎ��Θ§Εχ’τΑl(f®Γ)Οσ”–;έαàεί^ΗΏ�Θ§Εχ’τΑl(f®Γ)Οσί^ΒΆ��ΓΘ”–ΒΡ¨W(xu®Π)…ζ≥ΘΑ―èVΩΎΤΩ°î(d®Γng)≥…Φ·öβΤΩ Ι”Ο��Θ§ΨΆ“ρûι¦]”–Ηψ«εΥϋ²ÉΒΡÖ^(q®±)³e��ΓΘèVΩΎΤΩΗΫ”–…w�Θ§ « ΔΙΧσwΥéΤΖΒΡ»ίΤς;ΕχΦ·öβΤΩ¦]”–…wΘ§≥ΘΗζ≤ΘΝßΤ§≈δΧΉ Ι”Ο���ΓΘΦ·öβΤΩΤΩΩΎ…œ≤Ω����Θ§Ϋ¦(j®©ng)Ώ^ΡΞ…Α±»ί^Ήφ≤Ύ�����Θ§ΡΩΒΡ «ΆΩ…œΖ≤ ΩΝ÷Κσ‘Ό…w…œ≤ΘΝßΤ§�Θ§ ΙΒΟöβσw≤ΜΆβ“ίΓΘΕχèVΩΎΤΩΤΩΩΎ…œ≤Ω��Θ§¦]”–Ϋ¦(j®©ng)Ώ^ΡΞ…Α����ΓΘ
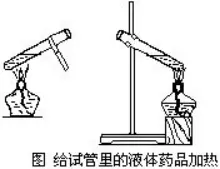
Μ·¨W(xu®Π)ÉxΤς‘ΎΉωΜ·¨W(xu®Π)¨çρûïrΫ¦(j®©ng)≥Θ”ΟΒΫΘ§¨W(xu®Π)ïΰ’ΐ¥_ Ι”ΟΏ@–©ÉxΤςΒΡΖΫΖ®����Θ§ « °Ζ÷÷Ί“ΣΒΡΓΘΟΩΖNÉxΤς��Θ§Ηυ™ΰ(j®¥)ΥϋΒΡ”ΟΆΨ≤ΜΆ§���Θ§”–÷χ≤ΜΆ§ΒΡ Ι”Ο“Σ«σ�ΓΘ“ρ¥ΥΘ§‘Ύ Ι”ΟΗςΖNΜ·¨W(xu®Π)ÉxΤς«ΑΕΦëΣ(y®©ng)‘™Ος¥_ΥϋΒΡ“Σ«σΦΑΏ@ΖN“Σ«σΒΡ‘≠“ρ��ΓΘάΐ»γ��Θ§ Ι”Οüΐ±≠ïr����Θ§ûιΝΥΖά÷Ιî΅Αηïr“ΚσwûR≥ωΜρ“Κσw“γ≥ωΘ§üΐ±≠Υυ Δ“Κσw≤ΜΒΟ≥§Ώ^ΥϋΒΡ»ίΖeΒΡ2/3;ûιΝΥΖά÷Ι”…”ΎΦ”üαïr ήüα≤ΜΨυ³ρΕχ Ιüΐ±≠ΤΤΝ―���Θ§Φ”üα«Α“ΣΑ―ΥϋΒΡΆβ±Ύ≤ΝΗ…�Θ§Φ”üαïrüΐ±≠ΒΉ“Σâ| ·ΟόΨW(w®Θng)�ΓΘΧΊ³e «“Μ–©»ί“Ή≥ω§F(xi®Λn)εe’`”ΟΖ®ΒΡÉxΤςΘ§Ηϋ–η“ΣΧΊ³eΉΔ“β���ΓΘάΐ»γ��Θ§”Ο‘΅ΙήäAäA≥÷‘΅Ιήïr�Θ§”–ΒΡ¨W(xu®Π)…ζΑ―Ρ¥÷ΗΑ¥‘ΎäAΒΡΜν³”≤ΩΖ÷����Θ§‘Ύ¨çρûΏ^≥Χ÷–�Θ§”…”Ύ≤Μ–Γ–ΡΡ¥÷ΗΑ¥³”ΝΥäAΒΡΜν³”≤ΩΖ÷��Θ§÷¬ Ι‘΅ΙήΟ™¬δΕχ¥ρΤΤ���ΓΘ“ρ¥ΥΘ§ Ι”Ο‘΅ΙήäAïr���Θ§“ΜΕ® °Ζ÷ΉΔ“βΡ¥÷Η«ß»f≤Μ“ΣΑ¥‘ΎäAΒΡΜν³”≤ΩΖ÷��ΓΘ
Μ·¨W(xu®Π)¨çρûΚσ����Θ§“ΣΦΑïrœ¥ΥΔ≤ΘΝßÉxΤς���Θ§≤Ν Ο�����ΓΔ’ϊάμΤδΥϋÉxΤς�����ΓΘ“ρûι��Θ§»γΜλ»κκsΌ|(zh®§)ΆυΆυïΰ”Αμë¨çρû–ßΙϊ���ΓΘΥυ“‘���Θ§“Σ«σΥυ Ι”ΟΒΡÉxΤς±Ίμö ««εùçΒΡΘ§”––©¨çρûΏÄ“Σ«σ «Η…‘οΒΡ��ΓΘΟΩ¥ΈΉωΆξ¨çρû��Θ§ëΣ(y®©ng)‘™ΝΔΦ¥Α―”ΟΏ^ΒΡ≤ΘΝßÉxΤςœ¥Éτ���ΓΘΆ®≥ΘΖ¥èΆ(f®¥)”ΟΥ°¦_œ¥éΉ¥Έ�Θ§»γΙϊÉ»(n®®i)±ΎΗΫ”–≤Μ“Ήœ¥ÉτΒΡΈοΌ|(zh®§)�Θ§‘Ό”Ο‘΅ΙήΥΔΥΔœ¥Θ§»γΙϊΗΫ”–≤Μ»ή–‘ΈοΌ|(zh®§)Μρ”Ά÷§�Θ§ΏÄ–ηΦ”ϊ}ΥαΜρüαâAΥΔœ¥ΓΘœ¥ÉτΒΡ‘΅ΙήëΣ(y®©ng)‘™Ζ≈‘Ύ‘΅ΙήΦή…œΝάΗ…�ΓΘ
Εΰ���Γđ艔’ΤΈ’Μ·¨W(xu®Π)ΥéΤΖΒΡ Ι”Ο?
¨çρûάοΥυ”ΟΒΡΥéΤΖ��Θ§”–ΒΡ”–ΕΨ–‘��Θ§”–ΒΡ”–Η·Έg–‘ΓΘ“ρ¥Υ����Θ§»Γ”ΟΜ·¨W(xu®Π)ΥéΤΖ”–÷χ΅ά(y®Δn)ΗώΒΡ“é(gu®©)Ε®ΓΘ“Σ«σΉωΒΫ“»ΐ≤Μ”��Θ§≤ΜΡή”Ο ÷Ϋ””|ΥéΤΖ���Θ§≤Μ“ΣΑ―±«ΩΉ€êΒΫ»ίΤςΩΎ»Ξ¬³öβσwΒΡöβΈΕΓΘ≤Μ‘S΅LΥéΤΖΒΡΈΕΒά����ΓΘ
»Γ”ΟΥéΤΖΘ§üo’™ «»ΓΝΩ���ΓΔΏÄ «»ΓΖ®���Θ§ΕΦ”–“é(gu®©)ΖΕ“Σ«σΓΘ“ΜΖΫΟφ“Σ’ΤΈ’»Γ”ΟΒΡ“ΣνI(l®Ϊng);Νμ“ΜΖΫΟφ“≤ëΣ(y®©ng)‘™«ε≥ΰΏ`“é(gu®©)ΒΡΈΘΚΠ���ΓΘάΐ»γ�Θ§»Γ”Ο“ΚσwΥéΤΖ���Θ§≥÷ΤΩΒΡ ÷���Θ§ëΣ(y®©ng)‘™Α―‰Υ(bi®Γo)Κûœρ÷χ ÷–Ρ���Θ§“‘ΟβΒΙΆξΥéΤΖΚσΘ§öàΝτ‘ΎΤΩΩΎΒΡΥé“ΚΝςœ¬¹μ����Θ§Η·Έg‰Υ(bi®Γo)ΚûΓΘ‘Ό»γ�Θ§Α―âK†νΙΧσwΜρΫπ¨ΌνwΝΘΖ≈ΏM(j®§n)‘΅ΙήΘ§≤ΜΡήΆΕ»κ÷±ΝΔΒΡ‘΅ΙήÉ»(n®®i)�Θ§ëΣ(y®©ng)‘™Α―‘΅ΙήôMΖ≈Θ§Ζ≈»κΙΧσwΚσ��Θ§‘Όάϊ”Ο–±ΟφΜ§œ¬“‘€p–ΓΥϋΒΡ¦_ΝΠ�����ΓΘΟβΒΟ¥ρΤΤ‘΅Ιή���ΓΘ‘SΕύΜ·¨W(xu®Π)¨çρû��Θ§≥Θ≥Θ–η“Σ»Γ”ΟΦs¬‘σwΖeΒΡ“Κσw�Θ§ëΣ(y®©ng)‘™¨W(xu®Π)ïΰΙά“ΚΒΡΦΦΡήΘ§“‘±ψ’ΤΈ’‘΅ΙήΒΡΗΏΕ»≈c“ΚσwσwΖeΒΡ¥÷¬‘ξP(gu®Γn)œΒ����ΓΘ
‘SΕύΜ·¨W(xu®Π)¨çρû–η“ΣΦ”üαΥéΤΖΘ§Φ”üαΥéΤΖ“≤”–“é(gu®©)ΖΕ“Σ«σ���ΓΘœώΫo‘΅Ιήάο“ΚσwΈοΌ|(zh®§)Φ”üα����Θ§≤ΜΒΪ¨ΠΥéΤΖΒΡ”ΟΝΩ���ΓΔΜπ―φΒΡ≤ΩΈΜΓΔÉA–±ΒΡΫ«Ε»”–÷χΟς¥_ΒΊ“Σ«σ��ΓΘ”»Τδ¨ΠΑ≤»Ϊ≤ΌΉςΒΡ“Σ«σ�����Θ§≤Μ»ίΚω“ï��Θ§ΥυΧαΒΫΒΡ“œ»Ψυ³ρ��ΓΔΚσΦ·÷–ΓΔΙήΩΎ»fΈπ¨Π÷χ»Υ”Φ”üαïr“ΜΕ®“ΣΉωΒΫ�ΓΘ
¥φΖ≈ΚΆ±ΘΙήΜ·¨W(xu®Π)ΥéΤΖΘ§Ηυ™ΰ(j®¥)ΥéΤΖΒΡ–‘Ό|(zh®§)≤…»Γ”––ßΒΡόkΖ®�ΓΘ“ΜΑψ¹μ’fΘ§»ή“ΚΉνΚΟ§F(xi®Λn)”Ο§F(xi®Λn)≈δ��Θ§≤Μ“ΥιLΤΎ¥φΖ≈��ΓΘ”–ΒΡΥéΤΖ“äΙβ��ΓΔ “€ΊΗΏ»ί“ΉΉÉΌ|(zh®§)��Θ§ëΣ(y®©ng)‘™Ζ≈‘ΎΚΎΑΒ��ΓΔΒΆ€ΊΒΡΒΊΖΫÉΠ¥φ����ΓΘ»γœθΥαΓΔœθΥαψyΒ»�ΓΘ”–ΒΡΥéΤΖ“äΩ’öβ“Ή―θΜ·ΓΔ“Ή≥±ΫβΜρ“ΉΗζΕΰ―θΜ·ΧΦΖ¥ëΣ(y®©ng)ΕχΉÉΌ|(zh®§)��Θ§ëΣ(y®©ng)‘™ΟήΖβ±Θ¥φ��ΓΘάΐ»γ�Θ§üΐâAΓΔΨGΒ\Β»ΓΘ”–ΒΡΥéΤΖ”–³ΓΕΨΜρèä(qi®Δng)Η·Έg–‘�����Θ§ΏÄ”–ΗςΉ‘ΒΡΧΊ β±Θ¥φΖΫΖ®��ΓΘ
ΝμΆβ��Θ§ΏÄëΣ(y®©ng)’ΤΈ’“Μ–©ΚÜÜΈ“Ή––ΒΡΧéάμ”…”ΎΥéΤΖΒΡΕΨ–‘ΜρΗ·Έg–‘ΕχΑl(f®Γ)…ζΒΡ ¬Ι ����ΓΘάΐ»γΘ§≤Μ…ςΑ―ùβΝρΥαûΔ‘ΎΤΛΡw…œ�Θ§“Σ―ΗΥΌ”Ο≤ΦΑ―ùβΝρΥα Ο»ΞΘ§≤≈Ρή”ΟΥ°¦_œ¥�����ΓΘ
»ΐ�Γđ艔’ΤΈ’Μ·¨W(xu®Π)¨çρûΒΡΜυ±Ψ≤ΌΉς?
Μ·¨W(xu®Π)¨çρûΒΡΜυ±Ψ≤ΌΉςΒΡΖNνêΚήΕύ��ΓΘάΐ»γ��Θ§Φ”üα����ΓΔ»ήΫβ����ΓΔΏ^ûV��ΓΔ’τΑl(f®Γ)���ΓΔ’τπs�����ΓΔΦ·öβ���ΓΔΫY(ji®Π)ΨßΓΔΒΈΕ®Β»����ΓΘΆ®≥ΘΒΡΜ·¨W(xu®Π)¨çρûάοΕΦΑϋΚ§÷χΗςΖNΜυ±Ψ≤ΌΉςΘ§÷Μ”–’ΤΈ’ΝΥΜυ±Ψ≤ΌΉς��Θ§≤≈ΡήΉωΚΟΜ·¨W(xu®Π)¨çρû���ΓΘάΐ»γ�����Θ§¥÷ϊ}ΒΡΧαΦÉΑϋά®ΝΥ»ήΫβ��ΓΔΏ^ûV�ΓΔ’τΑl(f®Γ)Β»Μυ±Ψ≤ΌΉςΓΘ
’ΤΈ’Μ·¨W(xu®Π)¨çρûΒΡΜυ±Ψ≤ΌΉς�����Θ§ Ήœ»“ΣΟς¥_≤ΌΉςΒΡ“ΣνI(l®Ϊng)ΚΆΒάάμ��ΓΘάΐ»γ����Θ§Φ”üαïrΘ§ëΣ(y®©ng)Α― ήüαΒΡΈοΌ|(zh®§)Ζ≈‘ΎΆβ―φ≤ΩΖ÷��Θ§“ρûιΨΤΨΪüτΒΡΜπ―φ”–―φ–Ρ�����ΓΔÉ»(n®®i)―φ��ΓΔΆβ―φ»ΐ²Ä≤ΩΖ÷���Θ§Άβ―φ»Φüΐ≥δΖ÷����Θ§Υυ“‘€ΊΕ»ΗΏ�ΓΘ»γΙϊΖ≈‘Ύ―φ–Ρ≤ΩΖ÷Θ§…θ÷Ν≈cüτ–ΨΫ””|���Θ§”…”Ύ≤ΘΝßÉxΤς ήüα≤ΜΨυ³ρ����ΓΔΡήΑl(f®Γ)…ζΤΤΝ―�ΓΘ”––©ί^èΆ(f®¥)κsΒΡ≤ΌΉςΘ§“Σ‘O(sh®®)Ζ® Ικy”¦ΒΡ“ΣνI(l®Ϊng)ΉÉΒΟ“Ή”¦����ΓΘάΐ»γΘ§Ώ^ûV≤ΌΉςΒΡ“ΣνI(l®Ϊng)Ω…“‘Η≈ά®ûι“»ΐΫ””|”��ΓΔ“ΕΰΒΆ”Ύ”����Θ§“‘±ψ”Ύ”¦ë¦ΓΘΥϋ±μ ΨΏ^ûVïr��Θ§¬©ΕΖΒΡœ¬ΕΥΙήΩΎΩΩΨo“Ϋ””|”ΒΫüΐ±≠ΒΡÉ»(n®®i)±ΎΓΔ≤ΘΝßΑτΒΡΡ©ΕΥ“ΣίpίpΒΊ“Ϋ””|”ΒΫ”–»ΐ¨”ûVΦàΒΡ“ΜΏÖ���ΓΔ Δë“ùα“ΚΒΡüΐ±≠ΩΎ“Σ“Ϋ””|”ΒΫ≤ΘΝßΑτ…œ�Θ§ Ι“Κσw―Ί÷χ≤ΘΝßΑτΝςΏM(j®§n)Ώ^ûVΤςάο����ΓΘûVΦàΖ≈»κ¬©ΕΖάοΘ§ûVΦàΒΡΏÖΨâëΣ(y®©ng)“ΒΆ”Ύ”¬©ΕΖΩΎ�����ΓΔœρ¬©ΕΖάοΒΙ»κΒΡ“ΚσwΒΡ“ΚΟφ“Σ“ΒΆ”Ύ”ûVΦàΒΡΏÖΨâ��ΓΘ
Μυ±Ψ≤ΌΉς÷Μ”–Ϋ¦(j®©ng)Ώ^Ζ¥èΆ(f®¥)ΨöΝï(x®Σ)��ΓΔΕύ¥Έ¨çέ`≤≈Ρή’φ’ΐΒΡ’ΤΈ’���Θ§≤ΜΡή÷Μ‘Ύ≥θ¨W(xu®Π)ïrΉΔ“βΜυ±Ψ≤ΌΉςΘ§ëΣ(y®©ng)‘™‘ΎΗςΖN¨çρûάο���Θ§ΕΦ÷Ί“ïΜυ±Ψ≤ΌΉςΓΘάΐ»γ����Θ§―b÷ΟöβΟή–‘ΒΡôzρû≤ΌΉς����Θ§‘Ύ÷ΤΗςΖNöβσw“‘«ΑΕΦ“ΣΉω����Θ§≤ΜΡή¥φ”–Ée–“–Ράμ���Θ§¥ΐ’ΐ Ϋ÷Τöβσwïr≤≈Αl(f®Γ)§F(xi®Λn)¬©öβΘ§Ζ¥Εχ―”’`ΝΥïrιg��ΓΘ
ΥΡ���Γđ艔’ΤΈ’öβσwΒΡ¨çρû?
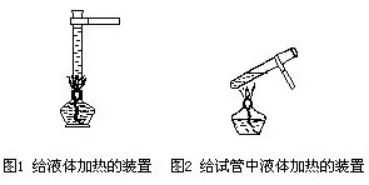
≥θ÷–Μ·¨W(xu®Π)¨çρû÷–Αϋά®ΝΥ÷Τ»Γ―θöβΓΔöδöβ���ΓΔΕΰ―θΜ·ΧΦ»ΐΖNöβσwΚΆ‘΅ρûöδöβΏÄ‘≠–‘Β»öβσw¨çρû���ΓΘ‘SΕύ¨W(xu®Π)…ζΉωöβσw¨çρûïr���Θ§≥Θ≥ΘΗ–ΒΫ ÷ΟΠΡ_¹yΓΔνô¥Υ ß±Υ��ΓΔκy”ΎΩΊ÷Τ���ΓΘΏ@≈cöβσwΖ¥ëΣ(y®©ng)ΥΌΕ»ί^Ωλ���Θ§¨çρû€ (zh®≥n)²δΙΛΉς≤ΜâρΘ§≤ΌΉς³”Ής≤ΜÖf(xi®Π)’{(di®Λo)Β»”–ξP(gu®Γn)�����ΓΘ
Ήωöβσw¨çρûΉν≈¬ΒΡ «¨çρûΈ¥Άξ≥…Εχöβσwîύ‘¥����Θ§Ϋβ¦QΏ@²ÄÜ•ν}ΒΡόkΖ® «Θ§Α―÷ΤöβσwΒΡΥéΤΖΖ≈ΒΟâρ”ΟΜρ¬‘”– Θ”ύ���ΓΘάΐ»γ÷Τ―θïr�Θ§Α―¬»Υαβ¦ΚΆΕΰ―θΜ·εiΒΡΜλΚœΈοΜρΗΏεiΥα⦀ (zh®≥n)²δΉψΝΩ��ΓΘ÷ΤöδïrΘ§Α―δ\ΝΘ€ (zh®≥n)²δΏ^ΝΩ�Θ§ϊ}ΥαΜρœΓΝρΥαΖ≈‘Ύ ÷ΏÖΘ§“‘²δöβΝς≤ΜΉψïr����Θ§κSïr‘ωΧμ”Ο���ΓΘΝμΆβ“ΣΉΔ“βΒΡ «��Θ§Ήωöβσw¨çρû«Α��Θ§’J(r®®n)’φôz≤ιöβΟή–‘����Θ§“‘Ζά¨çρûΏ^≥Χ÷–¬©öβ��ΓΘ
”Ο≈≈Υ°Ζ® ’Φ·öβσw«Α�Θ§ëΣ(y®©ng)‘™Α―€ (zh®≥n)²δΦ·öβ”ΟΒΡΦ·öβΤΩΘ§Ζ÷³e≥δùMΝΥΥ°�Θ§≤ΔΒΙΩέ‘ΎΥ°≤έΒΡΥ°Οφœ¬ΓΘ≤Μ“ΣΒ»ΒΫ‘™ ’Φ·ïr�Θ§‘ΌœρΦ·öβΤΩ÷–ΉΔ»κΥ°Φ»ΒΔîRΝΥïrιgΘ§”÷ΑΉΑΉΖ≈ΉΏ≤Μ…Όöβσw���ΓΘΝμΆβ��Θ§Υ°≤έάο ΔΒΡΥ°≤ΜΡήΧΪΕύ�Θ§“ΜΑψ“‘Ακ≤έûι“ΥΓΘ≤Μ»Μ�����Θ§°î(d®Γng)≈≈Υ°Φ·öβïr���Θ§Φ·öβΤΩάοΒΡΥ°ΏM(j®§n)»κΥ°≤έΟφ ΙΥ°“γ≥ω���ΓΘûιΝΥ±ψ”ΎΦ·öβΘ§ΉνΚΟ‘ΎΥ°≤έάοΖ≈ΏM(j®§n)Φ·öβΤΩΉυ����Θ§Α―≥δùMΥ°ΒΡΦ·öβΤΩΖ≈‘ΎΤΩΉυ…œΘ§Ώ@‰”���Θ§Ω…“‘ρv≥ω“Μ÷ß ÷¹μΉωΤδΥϊ≤ΌΉς���ΓΘΏÄ–ηΉΔ“β¨ß(d®Θo)öβΙή «ΖώΡήλ`Μν“Τ³”Θ§»γ≤Μâρλ`Μν���Θ§ëΣ(y®©ng)‘™’“’“‘≠“ρ���Θ§≤ΔΏM(j®§n)––’{(di®Λo)’ϊΜρΗϋ™Q��ΓΘ
Ήωöβσw¨çρûΚΆΤδΥϋ¨çρû“Μ‰”����Θ§“ΜΕ®“ΣΉΔ“βΑ≤»Ϊ��ΓΘάΐ»γ��Θ§‘Ύ ’Φ·Άξ―θöβΚσ���Θ§“Σœ»Α―¨ß(d®Θo)öβΙήèΡΥ°Οφ»Γ≥ωΘ§‘Ό“Τι_Φ”üα”ΟΒΡΨΤΨΪüτ�����Θ§“‘ΟβΑl(f®Γ)…ζΥ°≤έάοΒΡΥ°ΡφΝςΏM(j®§n)»κ‘΅ΙήΑl(f®Γ)…ζ ¬Ι ����ΓΘ‘Ό»γΘ§ϋc»Φ?x®§)δöβ«Α��Θ§“ΜΕ®“ΣôzρûΦÉΕ»Θ§“‘Ζά±§’®²ϊ»Υ��ΓΘΝμΆβ����Θ§èΡ–Ράμ…œΘ§“Σ«ιΨwΖÄ(w®ßn)³”����Θ§ΩΥΖΰΩ÷ë÷Η–Θ§≤≈Ρή Ι¨çρûΨoèàΕχ”––ρ�����Θ§³”ΉςΚΆ÷C��ΓΔΏBΊû���ΓΘ«ß»f≤Μ“Σ–ζ΅W��ΓΔφ“τ[���Θ§¨çρû≠h(hu®Δn)Ψ≥κs¹yΓΔ÷±Ϋ””Αμë÷χ¨çρûΒΡ–ßΙϊ����ΓΘ
Ήωöδöβ(Μρ“Μ―θΜ·ΧΦ)ΏÄ‘≠―θΜ·ψ~Β»ί^¥σ–Άöβσw¨çρû��Θ§ΫM―bÉxΤςïrëΣ(y®©ng)èΡΉσœρ”“��Θ§œ»―böδöβΑl(f®Γ)…ζΤς��Θ§‘Ό―bΦ”üα―θΜ·ψ~ΒΡ―b÷Ο���Θ§ΉνΚσ”Ο¨ß(d®Θo)öβΙήΏBΫ”Υϋ²ÉΓΘΫ¦(j®©ng)Ώ^ôz≤ιΉCΟςöβσwΝςœρï≥Ά®�����Θ§≤≈Ρή―bΏM(j®§n)ΥéΤΖΉω¨çρû���Θ§≤Μ“ΣΦ±”Ύ«σ≥…ΓΘ¨çρûΏ^≥Χ��Θ§“Σ΅ά(y®Δn)ΗώΉώ Ί≤ΌΉς“é(gu®©)³t�Θ§œ»Ά®öδöβΘ§≈≈Éτ’ϊ²Ä―b÷ΟάοΒΡΩ’öβ����Θ§‘ΌΦ”üα―θΜ·ψ~��Θ§Ω¥ΒΫΟςο@¨çρû–ßΙϊΚσ�Θ§“Τι_Φ”üαΒΡΨΤΨΪüτ��Θ§ά^άm(x®¥)Ά®öδöβ÷±ΒΫάδÖs��ΓΘ
Έε��Γđ艔’ΤΈ’ΧαΦÉΈοΌ|(zh®§)ΒΡΖΫΖ®?
―–ΨΩ»ΈΚΈ“ΜΖNΈοΌ|(zh®§)ΒΡ–‘Ό|(zh®§)��Θ§ΕΦ±Ίμö»Γ”ΟΦÉÉτΈο���ΓΘ“ρûι“ΜΖNΈοΌ|(zh®§)άο»γΙϊΚ§”–κsΌ|(zh®§)���Θ§ΨΆïΰ”ΑμëΏ@ΖNΈοΌ|(zh®§)ΙΧ”–ΒΡΡ≥–©–‘Ό|(zh®§)ΓΘΧαΦÉΈοΌ|(zh®§)ΒΡΖΫΖ®��Θ§ëΣ(y®©ng)‘™Ηυ™ΰ(j®¥)ΜλΚœΈοΗςΫMΖ÷ΒΡ–‘Ό|(zh®§)¹μΏx™ώ��ΓΘΫY(ji®Π)ΚœΨΏσw«ι¦r����Θ§Ω…“‘”ΟΈοάμΜρΜ·¨W(xu®Π)ΒΡΖΫΖ®Θ§ Ι≤ΜΦÉΈοΌ|(zh®§)ΉÉ?y®≠u)ι±»ί^ΦÉΒΡΈοΌ|(zh®§)�Θ§ΧαΦÉΈοΌ|(zh®§)ΒΡΈοάμΖΫΖ®�Θ§≥Θ“äΒΡ”–Ώ^ûVΖ®��ΓΔΫY(ji®Π)ΨßΖ®�����ΓΔ’τπsΖ®�ΓΔΖ÷“ΚΖ®ΓΔίΆ»ΓΖ®Β»�����ΓΘάΐ»γ����Θ§¨çρû “÷Τ―θöβΚσ��Θ§‘΅ΙήάοöàΝτΒΡΕΰ―θΜ·εi�����Θ§Ω…“‘Χα»Γ≥ω¹μ―≠≠h(hu®Δn) Ι”Ο�Θ§“Σ ΙΜλ»κ¬»Μ·β¦èΡΜλΚœΈο÷–≥ΐ»ΞΘ§Ω…≤…”ΟΏ^ûVΖ®����ΓΘ“ρûιΜλΚœΈο÷–ΒΡΕΰ―θΜ·εi≤Μ»ή”ΎΥ°�����Θ§¬»Μ·β¦“Ή»ή”ΎΥ°�ΓΘ
»γΙϊ”ΟΜ·¨W(xu®Π)ΖΫΖ®ΧαΦÉΈοΌ|(zh®§)���Θ§ëΣ(y®©ng)‘™‘O(sh®®)Ζ® ΙκsΌ|(zh®§)ΉÉ≥…“Ή≈c÷ς“ΣΫM≥…Ζ÷κxΒΡΈοΌ|(zh®§)����Θ§Μρ≈c÷ς“ΣΫM≥…œύΆ§ΒΡΈοΌ|(zh®§)�ΓΘ≤Μ“ΣΫ¦(j®©ng)Μ·¨W(xu®Π)ΧéάμΚσ”÷Μλ»κ–¬ΒΡκsΌ|(zh®§)ΓΘάΐ»γ��Θ§≥ΐ»Ξ“Μ―θΜ·ΧΦ÷–Μλ»κΒΡΕΰ―θΜ·ΧΦκsΌ|(zh®§)��Θ§Ω…“‘”Οöδ―θΜ·βc»ή“Κœ¥öβ��Θ§ ΙΕΰ―θΜ·ΧΦΗζöδ―θΜ·βcΖ¥ëΣ(y®©ng)Εχ»ήΫβ���Θ§≈c“Μ―θΜ·ΧΦΖ÷κx�ΓΘ‘Ό»γ���Θ§≥ΐ»Ξ¬»Μ·β¦÷–Μλ»κΒΡΧΦΥαβ¦κsΌ|(zh®§)�����Θ§Ω…“‘”ΟΦ”ϊ}ΥαΒΡΖΫΖ®����Θ§ ΙΧΦΥαβ¦Ηζϊ}ΥαΖ¥ëΣ(y®©ng)ΉÉ≥…Εΰ―θΜ·ΧΦ?x®§)β≈c¬»Μ·β¦Ζ÷κxΓΘΦΌ»γ�����Θ§Α―ϊ}Υα™Q≥…ΝρΥα�Θ§κm“≤ΡήΗζΧΦΥαβ¦Ζ¥ëΣ(y®©ng)ΉÉ≥…Εΰ―θΜ·ΧΦ≈c¬»Μ·β¦Ζ÷κxΘ§»ΜΕχ“ΐ»κΝρΥαΗυκxΉ”–¬ΒΡκsΌ|(zh®§)�����ΓΘ
K2CO3+2HCl=2KCl+CO2↑+H2O
K2CO3+H2SO4=K2SO4+CO2↑+H2O
Νυ�����Γđ艔’ΤΈ’ôzρûΈοΌ|(zh®§)≥…Ζ÷ΒΡ¨çρû?
”Ο¨çρûΖΫΖ®ôzρûΈοΌ|(zh®§)ΒΡ≥…Ζ÷ΥυΑϋά®ΒΡΖNνêΚήΕύ��ΓΘάΐ»γ���Θ§“―÷ΣΈοΌ|(zh®§)≥…Ζ÷ΒΡρûΉC��ΓΔηbΕ®Ρ≥ΈοΌ|(zh®§)÷– «ΖώΚ§”–Ρ≥ΖN≥…Ζ÷���ΓΔéΉΖNΈ¥÷ΣΈοΒΡηb³eΒ»ΓΘ Ήœ»�Θ§ëΣ(y®©ng)‘™≈Σ«ε≥ΰ¨çρûΥυ“Σ«σΒΡ «ΡΡ²Äνê–ΆΘ§Ηυ™ΰ(j®¥)“Σ«σ¹μ‘O(sh®®)”΄¨çρûΖΫΖ®��Θ§»ΜΚσ≤≈Ρή³” ÷¨çρû���ΓΘ
“―÷ΣΈοΌ|(zh®§)≥…Ζ÷ΒΡρûΉC����ΓΘ «”Ο¨çρûΖΫΖ®ΉCΟςΡ≥“―÷ΣΈοΌ|(zh®§)¥_¨çΚ§”–ΡΡ–©≥…Ζ÷����ΓΘάΐ»γΘ§ρûΉCΡëΒ\άοΚ§”–ψ~�����ΓΔΝρΥαΗυΚΆΫY(ji®Π)ΨßΥ°ΓΘΗυ™ΰ(j®¥)ΡëΒ\ΒΡ–‘Ό|(zh®§)�����Θ§”Ο÷±Ϋ”Φ”üαΖ÷ΫβΒΟΒΫüoΥ°ΝρΥαψ~ΚΆΥ°�����Θ§ΉCΟςΥϋΚ§”–ΫY(ji®Π)ΨßΥ°;Α―ΡëΒ\(Μρ ήüαΖ÷ΫβΚσΒΡüoΥ°ΝρΥαψ~)»ή”Ύ≈δ≥…ΝρΥαψ~»ή“Κ��Θ§Φ”»κ¬»Μ·δ^…ζ≥…≤Μ»ή”ΎœΓœθΥαΒΡΝρΥαδ^≥ΝΒμ���Θ§ΉCΟςΥϋΚ§”–ΝρΥαΗυ;”ΟηFαîΜρδ\Τ§Ζ≈»κΝρΥαψ~»ή“ΚΡή÷Ο™Q≥ωΫπ¨Όψ~���Θ§ΉCΟςΥϋΚ§”–ψ~ΓΘ
ηbΕ®Ρ≥ΈοΌ|(zh®§) «Ζώïΰ”–Ρ≥≥…Ζ÷�����ΓΘëΣ(y®©ng)‘™άϊ”ΟΡ≥≥…Ζ÷ΒΡΧΊ’ςΖ¥ëΣ(y®©ng)Φ”“‘≈–îύ��ΓΘάΐ»γ��Θ§“ΣÜ•Ρ≥ΒV · «ΖώΚ§”–ΧΦΥαϊ}���Θ§ëΣ(y®©ng)‘™άϊ”ΟΧΦΥαϊ}Ηζϊ}ΥαΖ¥ëΣ(y®©ng)ΡήΖ≈≥ωΕΰ―θΜ·ΧΦΒΡΧΊ’ςΖ¥ëΣ(y®©ng)�ΓΘ‘Ό»γ���Θ§“ΣÜ•Ρ≥»ή“Κ «ΖώΚ§”–¬»κxΉ”���Θ§ëΣ(y®©ng)‘™άϊ”ΟœθΥαψy»ή“ΚάοΒΡψyκxΉ”ΓΔΗ欻κxΉ”Ρή…ζ≥…≤Μ»ή”ΎœΓœθΥαΒΡ¬»Μ·ψy≥ΝΒμΒΡΧΊ’ςΖ¥ëΣ(y®©ng)�����ΓΘ
ηb³eéΉΖNΈ¥÷ΣΈοΌ|(zh®§)���Θ§ëΣ(y®©ng)Ηυ™ΰ(j®¥)éΉΖNΈοΌ|(zh®§)‘ΎΆ§“ΜΖ¥ëΣ(y®©ng)÷–±μ§F(xi®Λn)≥ωΒΡ≤ΜΆ§§F(xi®Λn)œσ(Μρ≤ΜΖ¥ëΣ(y®©ng))Φ”“‘Ö^(q®±)Ζ÷���ΓΘΏx”ΟΒΡΖΫΖ®“ΣΚܱψ“Ή––ΓΘ”–ïr“Μ≤Ϋηb³e≤Μι_��Θ§ΏÄ–ηÉ…≤Ϋ��ΓΔ…θ÷Ν»ΐ≤Ϋ��ΓΘάΐ»γ�Θ§ηb³e―θöβ��ΓΔΒΣöβ�ΓΔöδöβΚΆΕΰ―θΜ·ΧΦΥΡΖNöβσw��Θ§–η“ΣÉ…≤Ϋηb³e��Θ§ΒΎ“Μ≤Ϋ”Ο“ΜΗυ»Φ÷χΒΡΡΨ½l�Θ§Ζ÷³eΫ””|ΥΡΖNöβσwΘ§ ΙΡΨ½l»ΦüΐΗϋΦ”³ΓΝ“ΒΡ «―θöβ��Θ§ΡήΑ―öβσwϋc»ΦΒΡöδöβ����Θ§ ΙΜπ―φœ®€γΒΡΒΣöβΚΆΕΰ―θΜ·ΧΦΓΘ–ηΏM(j®§n)––ΒΎΕΰ≤Ϋ���Θ§”Ο≥Έ«εΒΡ ·Μ“Υ°ηb³e��Θ§ Ι ·Μ“Υ°ΉÉ€ÜùαΒΡ «Εΰ―θΜ·ΧΦ�Θ§Νμ“ΜΖN «ΒΣöβ�ΓΘ
ΤΏΓđ艔ΉωΚΟΕ®ΝΩ¨çρû?
≥θ÷–Μ·¨W(xu®Π)¨çρûάο”––©¨Ό”ΎΕ®ΝΩΖΫΟφΒΡ��Θ§»γ≈δ÷Τ“ΜΕ®»ήΌ|(zh®§)ΒΡΌ|(zh®§)ΝΩΖ÷?j®Ϊn)?sh®¥)
ΒΡ»ή“Κ����ΓΔ€yΕ®œθΥαβ¦ΒΡ»ήΫβΕ»Β»��ΓΘΉωΕ®ΝΩ¨çρû«ΑΘ§Ηυ™ΰ(j®¥)“Σ«σ ¬œ»”΄Υψ≥ω”–ξP(gu®Γn)îΒ(sh®¥)™ΰ(j®¥)�����ΓΘάΐ»γ����Θ§”Ο37%(ΟήΕ»ûι1.19g/cm3)ΒΡùβϊ}ΥαœΓα¨≥…200g20%ΒΡœΓϊ}ΥαΓΘ Ήœ»���Θ§“ΣΫ¦(j®©ng)Ώ^”΄ΥψΫβ¦Q–η”ΟΕύ…ΌΚΝ…ΐùβϊ}Υα���Θ§Εύ…ΌΚΝ…ΐΥ°ΓΘ

ΉωΕ®ΝΩ¨çρû“Σ Ι”ΟΆ–±PΧλΤΫ���ΓΔΝΩΆ≤Β»ÉxΤς��ΓΘëΣ(y®©ng)‘™’ΤΈ’ΈοΌ|(zh®§)ΒΡΖQΝΩΚΆ“ΚσwΒΡΝΩ»ΓΒ»Ε®ΝΩ¨çρûΒΡΜυ±Ψ≤ΌΉς�ΓΘάΐ»γ����Θ§ Ι”ΟΆ–±PΧλΤΫïr�����Θ§ëΣ(y®©ng)Ήσ±PΖ≈ΖQΝΩΈο��Θ§”“±PΖ≈μά¥a;”Οη΅Ή”äA»ΓΖ®¥a;”ΟΦàΤ§Μρ»ίΤς ΔΖ≈ΖQΝΩΈο; Ι”ΟΆξ°Ö¨ΔÉ…±PΖ≈‘Ύ“ΜΤπΒ»���ΓΘ
Ώx™ώΝΩΨΏïrΘ§“ΣΉΔ“β≈cΥυ“ΣΉωΒΡΕ®ΝΩœύΏmëΣ(y®©ng)����ΓΘάΐ»γΘ§ Ι”ΟΝΩΆ≤ΝΩ»Γ“ΜΕ®σwΖe“Κσwïr���Θ§Ηυ™ΰ(j®¥)–η“ΣΝΩ»ΓΒΡ“ΚσwΒΡσwΖe��Θ§Ώx™ώΚœΏmΝΩ≥ΧΒΡΝΩΆ≤�ΓΘœσ…œ ω≈δ÷Τ20%œΓϊ}Υα��Θ§“ΣΝΩ»Γ90.91mLΒΡùβϊ}Υα�����ΓΘëΣ(y®©ng)‘™Ώx™ώ»ίΖeûι100mLΒΡΝΩΆ≤ΓΘ≤ΜΡήΏx™ώ50mLΝΩΆ≤���Θ§Ζ÷É…¥ΈΝΩ»Γ��Θ§Ηϋ≤ΜΡή”Ο10mLΝΩΆ≤��Θ§Ζ÷ °¥ΈΝΩ»Γ��ΓΘ“ρûιΘ§Εύ¥ΈΝΩ»ΓΒΡΏ^≥Χ÷–��Θ§”…”Ύ≤ΌΉς�����ΓΔ”^≤λΒ»“ΐΤπΒΡ’`≤νΩ²ΚΆ±»“Μ¥ΈΝΩ»ΓΒΡ¥σ����ΓΘΝμΆβΘ§ΝΩΆ≤¨Ό”Ύί^¥÷¬‘ΝΩ»Γ“ΚσwσwΖeΒΡÉxΤς��Θ§“ΜΑψ÷ΜΡή”^≤λΨΪ¥_ΒΫ’ϊîΒ(sh®¥)ΈΜ���Θ§ΒΎ“ΜΈΜ–ΓîΒ(sh®¥) «ΙάΝΩ≥ω¹μΒΡ��Θ§≤ΜâρΨΪ¥_��ΓΘ“≤ΨΆ «’f��Θ§¨çρû “Υυ”ΟΒΡ100mL»ίΖeΒΡΝΩΆ≤���Θ§≤ΜΩ…ΡήΨΪ¥_ΒΊΝΩ≥ω90.91mLΒΡùβϊ}Υα�Θ§÷Μ¥÷¬‘ΒΫ91mL(ΉΔΘΚ≥θ÷–÷Μ“Σ«σ”ΟΝΩΆ≤)��ΓΘΉωΕ®ΝΩ¨çρûïr��Θ§ëΣ(y®©ng)‘™Ή–Φö(x®§)���ΓΔ’J(r®®n)’φ�Θ§≤Μ“ΣûΔ≥ω����Θ§Βτ¬δΜρΜλ»κκsΌ|(zh®§)Εχ”Αμë¨çρûΒΡΨΪ¥_Ε»ΓΘ
ΑΥ���ΓΔ‘ΎΜ·¨W(xu®Π)¨çρû÷–ëΣ(y®©ng)ΉΔ“βΡΡ–©Ü•ν}?
”…”Ύ¨çρû “άοΥυ”ΟΒΡΜ·¨W(xu®Π)ΥéΤΖ”–ΒΡ”–ΕΨ–‘���ΓΔ”–ΒΡ”–Η·Έg–‘��ΓΘ“ρ¥Υ‘ΎΜ·¨W(xu®Π)ΥéΤΖΒΡ Ι”Ο÷–”–“‘œ¬Νυ²Äà‘¦Q≤Μ€ (zh®≥n)‘SΒΡÜ•ν}���ΓΘ
(1)≤ΜΡή”Ο ÷Ϋ””|ΥéΤΖΓΘ
(2)≤Μ“ΣΑ―±«ΩΉ€êΒΫ»ίΤςΩΎ»Ξ¬³öβσwΜρΤδΥϋΙΧσw���ΓΔ“ΚσwΥéΤΖΒΡöβΈΕ��ΓΘ
(3)≤Μ‘S΅LΥéΤΖΒΡΈΕΒά���ΓΘ
(4)¨çρû”Ο ΘΒΡΥéΤΖ“ΣΫΜΜΊ¨çρû “�����Θ§≤Μ“Σ£¹½â��ΓΘ
(5)èΡ‘΅³©ΤΩ÷–ΒΙ≥ωΒΡ“ΚσwΥéΤΖ¦]”–”ΟΆξ�����Θ§ Θ”ύ≤ΩΖ÷≤Μ‘SΒΙΜΊ‘≠ΤΩ÷–�Θ§“‘Οβ”ΑμëΥéΤΖΒΡΦÉΕ»ΜρùβΕ»ΓΘ
(6)¨çρû “÷–ΒΡΥéΤΖ≤ΜΡή≈≤ΉςΥϋ”Ο(»γ ≥ϊ}��ΓΔΑΉΧ«“≤≤ΜΡήΫo»ΈΚΈ»Υ°î(d®Γng)’{(di®Λo)ΈΕΤΖ”Ο)ΓΘ
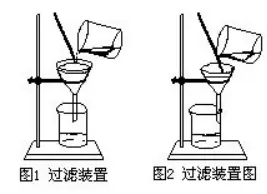
1.ΙΧσwΥéΤΖ»Γ”ΟïrëΣ(y®©ng)ΉΔ“βΡΡ–©Ü•ν}?
(l)»Γ”ΟΙΧσwΥéΤΖïrΥé≥Ή±Ίμö «Η…ÉτΒΡ��ΓΘ“Μ÷ßΥé≥Ή≤ΜΡήΆ§ïr»Γ”ΟÉ…ΖNΜρÉ…ΖN“‘…œΒΡ‘΅³©��ΓΘΥé≥ΉΟΩ»ΓΆξ“ΜΖN‘΅³©ΚσΕΦ±Ίμö”ΟΗ…ÉτΒΡΦà≤Ν ΟΗ…Éτ��Θ§“‘²δœ¬¥Έ Ι”Ο���ΓΘΥé≥ΉΒΡÉ…ΕΥûι¥σ–ΓÉ…≥Ή�����Θ§»ΓΙΧσwΝΩί^Εύïr”Ο¥σ≥Ή�����Θ§ί^…Όïr”Ο–Γ≥Ή�����ΓΘ
(2)Άυ‘΅Ιήάο―b»κΙΧσwΖέΡ©ïr���Θ§ûι±ήΟβΥéΤΖ’¥‘ΎΙήΩΎΚΆΙή±Ύ…œΘ§‘΅ΙήëΣ(y®©ng)ÉA–±Θ§Α― Δ”–ΥéΤΖΒΡΥé≥Ή–Γ–ΡΒΊΥΆ»κ‘΅ΙήΒΉ≤Ω�����Θ§»ΜΚσ Ι‘΅Ιή÷±ΝΔΤπ¹μ��Θ§Ή¨ΥéΤΖ»Ϊ≤Ω¬δ‘ΎΒΉ≤Ω��Γ�ΘΜρ?q®±)Δ‘΅ΙήΥ°ΤΫΖ≈÷ΟΘ§Α―ΙΧσwΖέΡ©Ζ≈‘Ύ’έ·B≥…≤έ†νΒΡΦà½l…œ��Θ§»ΜΚσΥΆ»κ‘΅ΙήΙήΒΉ��Θ§»Γ≥ωΦà½l���Θ§¨Δ‘΅Ιή÷±ΝΔΤπ¹μ�ΓΘ
(3)âK†νΙΧσwΥéΤΖ(»γβ¦���ΓΔβcΓΔΑΉΝΉ���ΓΔ¥σάμ ·��ΓΔ ·Μ“ ·�����ΓΔδ\ΝΘΒ»)–ηœ»”Οη΅Ή”»Γ≥ω��Θ§ΉΔ“βη΅Ή” Ι”ΟΆξ“‘Κσ“ΣΝΔΩΧ”ΟΗ…ÉτΒΡΦà≤Ν ΟΗ…Éτ�Θ§“‘²δœ¬¥Έ Ι”ΟΓΘΑ―âK†νΒΡΥéΤΖΜρΟήΕ»ί^¥σΒΡΫπ¨ΌνwΝΘΖ≈»κ‘΅Ιή÷–ïr�Θ§ëΣ(y®©ng)‘™œ»Α―‘΅ΙήôMΖ≈Θ§Α―ΥéΤΖΜρΫπ¨ΌνwΝΘΖ≈»κ‘΅Ιή���ΓΘ“‘Κσ�����Θ§‘ΌΑ―‘΅Ιή¬ΐ¬ΐΒΊΊQΝΔΤπ¹μ�Θ§ ΙΥéΤΖΜρΫπ¨ΌνwΝΘΨèΨèΒΊΜ§ΒΫ»ίΤςΒΡΒΉ≤Ω��Θ§“‘Οβ¥ρΤΤ‘΅ΙήΓΘ
2.»γΚΈ¨Δ“ΚσwΥéΤΖΒΙ»κ‘΅Ιή÷–?
“ΚσwΥéΤΖΆ®≥Θ Δ‘ΎΦö(x®§)ΩΎΤΩάοΓΘ»Γ”ΟΒΡïrΚρ��Θ§œ»Α―ΤΩ»ϊΡΟœ¬Θ§ΒΙΖ≈‘ΎΉά…œ����ΓΘ»ΜΚσ“Μ ÷ΡΟΤπΤΩΉ”(ΉΔ“βΤΩ…œΒΡ‰Υ(bi®Γo)ΚûëΣ(y®©ng)œρ÷χ ÷–Ρ���Θ§“‘ΟβΒΙΆξΥéΤΖΚσΘ§öàΝτ‘ΎΤΩΩΎΒΡΥé“ΚΝςœ¬¹μ�Θ§Η·Έg‰Υ(bi®Γo)Κû)Θ§Νμ“Μ ÷¬‘–±ΒΊΑ―‘΅Ιή≥÷ΚΟ���Θ§ ΙΤΩΩΎΨoΑΛ÷χ‘΅ΙήΩΎ�����Θ§Α―“ΚσwΨèΨèΒΊΒΙ»κ‘΅Ιήάο�����ΓΘΒΙ≥ω“ΚσwΒΡσwΖeΒΫ¨çρûΥυ–ηîΒ(sh®¥)ΝΩïrûι÷Ι��ΓΘ°î(d®Γng)–η”Ο“ΚσwΒΙΆξΚσ�Θ§Α―‘΅ΙήΩΎ‘ΎΤΩΩΎΧé≤δéΉœ¬��Θ§ ΙöàΝτ‘ΎΤΩΩΎΧéΒΡΥé“Κ“≤Νς»κΒΫ‘΅Ιή÷–�ΓΘ»ΜΚσΝΔΦ¥…wΨoΤΩ»ϊ��Θ§Α―ΤΩΉ”Ζ≈ΜΊ‘≠ΧéΘ§≤ΔΉΔ“β ΙΤΩ…œΒΡ‰Υ(bi®Γo)ΚûœρΆβ��ΓΘ
3.. Ι”ΟΜ·¨W(xu®Π)‘΅³©ëΣ(y®©ng)°î(d®Γng)ΉΔ“βΒΫΡΡ–©Ü•ν}?
(l)Ζ÷―bΙΧσw‘΅³©ïr��Θ§ëΣ(y®©ng)¨ΔΥϋ ΔΖ≈‘Ύéß»ϊΒΡèVΩΎΤΩάοΜρéß”–ΡΞΩΎ≤ΘΝß»ϊΒΡ¥σΩΎ‘΅³©ΤΩ÷–��ΓΘ
(2)Ζ÷―b“Κσw‘΅³©ïr��Θ§“Κσw‘΅³©ëΣ(y®©ng) ΔΖ≈‘ΎΦö(x®§)ΩΎΤΩ÷–��Θ§Μρéß”–ΡΞΩΎ≤ΘΝß»ϊΒΡΦö(x®§)ΩΎΤΩ÷–��ΓΘ…ΌΝΩ“ΚσwΩ…Ζ≈‘ΎΒΈΤΩ÷–�ΓΘ“äΙβ“ΉΖ÷ΫβΒΡ“Κσw‘΅³©ΏÄëΣ(y®©ng)ΉΔ“βΖ≈‘ΎΉΊ…ΪΒΡ‘΅³©ΤΩ÷–ΓΘöδ―θΜ·βcΒ»èä(qi®Δng)âA–‘»ή“ΚëΣ(y®©ng)ΌA¥φ‘ΎéßœπΡz»ϊ(ΜρΥήΝœ»ϊ��ΓΔΜρή¦ΡΨ»ϊ)ΒΡΦö(x®§)ΩΎΤΩάο(“ρ Ι”Ο≤ΘΝß»ϊΚή»ί“Ή‘λ≥…ΤΩ»ϊ≈cΤΩΩΎΒΡ’≥ΏB)�ΓΘ
( 3)ι_ÜΔ Δ”–“Ή™]Αl(f®Γ)ΒΡ“Κσw(»γùβΑ±Υ°ΓΔùβϊ}Υα���ΓΔùβœθΥα���ΓΔ“ΚδεΒ»)‘΅³©ΤΩΒΡΤΩ»ϊïrΘ§ΤΩΩΎ≤ΜΡή¨Π÷χΟφ≤Ω�Θ§”»Τδ≤ΜΡή¨Π÷χ―έΨΠ���Θ§“‘ΖάΤΩ»ϊι_ÜΔΚσΘ§ΤΩÉ»(n®®i)’τΤϊ΅ä≥ω²ϊΚΠ―έΨΠΜρΆ®Ώ^ΩΎ±«Έϋ»κσwÉ»(n®®i)���ΓΘ
(4)¨çρûΚσΒΡΖ¥ëΣ(y®©ng)Έοöà‘ϋ��ΓΔèU“Κ≤ΜΡήκS±ψΒΙΒτ�Θ§ëΣ(y®©ng)ΒΙ»κ÷ΗΕ®»ίΤςÉ»(n®®i)����ΓΘΧΊ³e «“Μ–©“Ή»ΦΓΔ”–èä(qi®Δng)Η·Έg–‘���ΓΔ”–ΕΨΒΡΈΘκUΤΖ(»γΑΉΝΉ���ΓΔΫπ¨ΌβcΓΔùβΥα�����ΓΔ”–ôC(j®©)»ή³©ΦΑΕΨΤΖΒ»)±ΊμöΫ¦(j®©ng)Ώ^ΆΉ…ΤΧéάμΚσ���Θ§≤≈ΡήΒΙ»κèU“ΚΗΉ÷–��ΓΘ
4. Ι”Ο≤ΘΝßÉxΤςëΣ(y®©ng)ΉΔ“βΡΡ–©Ü•ν}?
(l)Ω…“‘Φ”üαΒΡΝßÉxΤς”–‘΅Ιή���ΓΔüΐ±≠��ΓΔüΐΤΩ(àAΒΉüΐΤΩ�ΓΔΤΫΒΉüΐΤΩ)ΓΔ’τπsüΐΤΩ(àAΒΉ’τπsüΐΤΩ��ΓΔΤΫΒΉ’τπsüΐΤΩ)ΓΔεF–ΈΤΩ����ΓΘ
(2)≤ΜΩ…“‘”ΟΨΤΨΪüτ÷±Ϋ”Φ”üα�����Θ§Εχ‘Ύâ|…œ ·ΟόΨW(w®Θng)“‘ΚσΩ…“‘Φ”üαΒΡ≤ΘΝßÉxΤς”–üΐ±≠��ΓΔüΐΤΩ(àAΒΉüΐΤΩ�����ΓΔΤΫΒΉüΐΤΩ)���ΓΔ’τπsüΐΤΩ(àAΒΉ’τπsüΐΤΩΓΔΤΫΒΉ’τπsüΐΤΩ)�ΓΔεF–ΈΤΩ���ΓΘ
(3)ÜΔΤ’Αl(f®Γ)…ζΤς��ΓΔΦ·öβΤΩΓΔ±μΟφΟσ��ΓΔΗ…‘οΙήΏ@–©≤ΘΝßÉxΤς�Θ§‘Ύ Ι”Οïr≤ΜΡήΦ”üα��Θ§ΒΪΩ…“‘‘Ύ≤ΜΦ”üαΒΡ½lΦΰœ¬Θ§‘ΎΏ@–©ÉxΤς÷–ΏM(j®§n)––Μ·¨W(xu®Π)Ζ¥ëΣ(y®©ng)�ΓΘ
(4)‘Ύ Ι”Οïr≤ΜΡήΦ”üαΘ§“≤≤ΜΡή‘ΎΤδ÷–ΏM(j®§n)––Μ·¨W(xu®Π)Ζ¥ëΣ(y®©ng)ΒΡ≤ΘΝßÉxΤς”–ΘΚΡzν^ΒΈΙή�ΓΔΖ÷“Κ¬©ΕΖ���ΓΔιLνi¬©ΕΖΓΔΥ°≤έ�ΓΔΝΩΆ≤�����ΓΔΥα ΫΒΈΕ®ΙήΓΔâA ΫΒΈΕ®Ιή��ΓΔΗ…‘οΤςΓΔ‘΅³©ΤΩ��ΓΔΒΈΤΩ��ΓΔάδΡΐΙήΓΘ
5..‘艔œ¥ΥΔ≤ΘΝßÉxΤς?
ΉωΜ·¨W(xu®Π)¨çρû±Ίμö”ΟΗ…ÉτΒΡ≤ΘΝßÉxΤς���Θ§Ζώ³tïΰ”Αμë¨çρûΒΡ–ßΙϊ�����ΓΘΉωΆξ¨çρûΚσ��Θ§ëΣ(y®©ng)‘™ΝΔΦ¥Α―”ΟΏ^ΒΡ≤ΘΝßÉxΤςœ¥ΥΔΗ…Éτ���ΓΘ
œ¥ΥΔ‘΅ΙήΜρüΐΤΩΒΡΖΫΖ® «œ»ΉΔ»κΑκΙήΜρΑκΤΩΥ°���Θ§…‘…‘”ΟΝΠ’ώ é���Θ§Α―Υ°ΒΙΒτΘ§’’Ώ@‰”ΏBœ¥îΒ(sh®¥)¥Έ����ΓΘ»γΙϊÉ»(n®®i)±ΎΗΫ”–≤Μ“Ήœ¥ΒτΒΡΈοΌ|(zh®§)Θ§Ω…“‘”Ο‘΅ΙήΥΔœ¥��ΓΘΥΔœ¥ïr��Θ§ Ι‘΅ΙήΥΔ‘Ύ Δ”–Υ°ΒΡ‘΅ΙήΜρüΐΤΩάοόD(zhu®Θn)³”Μρ…œœ¬“Τ³”Θ§ΒΪ”ΟΝΠ≤ΜΒΟΏ^ΟΆ��Θ§Ζώ³t»ί“ΉΑ―‘΅ΙήΒΉ≈ΣΤΤ�ΓΘ
Ϋ¦(j®©ng)…œ ωΥΔœ¥Κσ��Θ§≤ΘΝßÉxΤςάο»‘”–öàΝτΈοΒΡΚέέEΘ§³t“ΣΗυ™ΰ(j®¥)öàΝτΈοΒΡ–‘Ό|(zh®§)Ώx”ΟΏm°î(d®Γng)?sh®¥)ΡΜ·¨W(xu®Π)ΥéΤΖ¹μœ¥€λ���ΓΘ
≤ΘΝßÉxΤςœ¥ΥΔΗ…ÉτΒΡ‰Υ(bi®Γo)€ (zh®≥n) «‘Ύ≤ΘΝßÉ»(n®®i)±Ύ±μΟφΗΫ÷χΒΡΥ° «Ψυ³ρΒΡ��Θ§–Έ≥…“Μ¨”Ψυ³ρΒΡΥ°ΡΛΘ§≤ΘΝßÉ»(n®®i)±Ύ…œΒΡΥ°Φ»≤ΜΨέ≥…Υ°ΒΈ���ΓΔ“≤≤Μ≥…Ι…Νςœ¬��Θ§Ώ@‰”≤≈Υψœ¥Η…ÉτΝΥ���ΓΘ
6.. Ι”Ο’τΑl(f®Γ)ΟσïrëΣ(y®©ng)ΉΔ“β–© ≤Ο¥?
(1)ΏM(j®§n)––»ή“ΚΒΡùβΩsΜρ?q®±)Δ»ή“Κ’τΑl(f®Γ)÷ΝΗ…ïr��Θ§–η¨Δ’τΑl(f®Γ)ΟσΖ≈÷Ο‘Ύ»ΐΡ_Φή…œΜρηFΦή≈_ΒΡηF»Π…œ���Θ§Ω…“‘”ΟΨΤΨΪüτ÷±Ϋ”Φ”üαΓΘ
(2)ùβΩs»ή“Κïr��Θ§‘Ύ’τΑl(f®Γ)Οσ÷–»ή“ΚΒΡΝΩΉνΕύ≤Μ“Σ≥§Ώ^»ίΖeΒΡ»ΐΖ÷÷°ΕΰΓΘΏÄëΣ(y®©ng)‘™”Ο≤ΘΝßΑτ≤ΜΆΘΒΊΏM(j®§n)––î΅Αη���ΓΘ
(3)»τ“ΣΑ―»ή“Κ’τΑl(f®Γ)÷ΝΗ…���Θ§°î(d®Γng)Ω¥ΒΫ’τΑl(f®Γ)Οσ÷–”–¥σΝΩ»ήΌ|(zh®§)Έω≥ωΚσΘ§≥ΐ»ΞëΣ(y®©ng)‘™”Ο≤ΘΝßΑτ≤ΜΆΘΒΊά^άm(x®¥)î΅ΑηΆβ��Θ§ΏÄëΣ(y®©ng)‘™≥Ζ»ΞΨΤΨΪüτ����Θ§”Ο”ύüα Ι»ή“Κ’τΑl(f®Γ)÷ΝΗ…����Θ§“‘Ζά“ρ²ςüα≤ΜΚΟΕχΑl(f®Γ)…ζ±≈ûRΓΘ
(4)≤ΜΏm“Υ‘Ύ’τΑl(f®Γ)Οσ÷–ùβΩsöδ―θΜ·βcΒ»èä(qi®Δng)âA»ή“Κ���Θ§“‘Οβ’τΑl(f®Γ)ΟσÉ»(n®®i)±ΎΒΡ”‘Οφ ήΒΫ΅ά(y®Δn)÷ΊΒΡΗ·Έg��ΓΘ
(5)»ΓΖ≈’τΑl(f®Γ)ΟσΕΦëΣ(y®©ng)‘™”Οέαε¹ψQäAΉΓ“‘Κσ‘Ό»ΓΖ≈���ΓΘ
7..ϋc»ΦΨΤΨΪüτïrûι ≤Ο¥≤ΜΡήΒΫΝμ“Μ²Ä»Φ÷χΒΡΨΤΨΪüτ…œ¨ΠΜπ?
°î(d®Γng)”Ο ÷ΡΟ÷χ“Μ±KΨΤΨΪüτΒΫΝμ“Μ²Ä»Φ÷χΒΡΨΤΨΪüτ…œΟφ»ΞϋcΜπïrΘ§ ÷≥÷ΒΡΨΤΨΪüτ±Ί»Μ“ΣÉA–±�Θ§Ώ@‰”»ίΤςÉ»(n®®i)ΒΡΨΤΨΪ“≤±Ί»ΜûΔ≥ω¹μΘ§Νς‘Ύ»Φ÷χΒΡΨΤΨΪüτ…œΟφΕχ‘λ≥… ßΜπ§F(xi®Λn)œσ���ΓΘûιΝΥ±ήΟβ ßΜπ§F(xi®Λn)œσΒΡΑl(f®Γ)…ζ����Θ§Υυ“‘Ϋ^¨ΠΫϊ÷ΙΡΟΨΤΨΪüτΒΫΝμ“Μ“―Ϋ¦(j®©ng)»Φ÷χΒΡΨΤΨΪüτ…œ»ΞϋcΜπ���ΓΘ
8.ëΣ(y®©ng)‘™‘艔 Ι”Ο‘΅ΙήäA?
‘ΎΫo‘΅ΙήάοΒΡΈοΌ|(zh®§)Φ”üαïr����Θ§ΨΆ–η“Σ Ι”Ο‘΅ΙήäA���ΓΘ”Ο‘΅ΙήäAäA≥÷‘΅ΙήΒΡ’ΐ¥_≤ΌΉςΖΫΖ® «¨Δ‘΅ΙήäAèΡ‘΅ΙήΒΡΒΉ≤ΩΆυ…œΧΉΓΘäA‘Ύ‘΅ΙήΒΡ÷–…œ≤Ω���ΓΘ»τ¨Δ‘΅ΙήιLΕ»»ΐΒ»Ζ÷ïr�Θ§³t‘΅ΙήäAäA‘ΎΩΩΫϋ‘΅ΙήΩΎΒΡΡ«ΕΥ»ΐΖ÷÷°“ΜΒΡ≤ΩΈΜ“‘É»(n®®i)ûιΚœάμ�ΓΘ”Ο ÷ΡΟ‘΅ΙήäAïr���Θ§“ΣΉΔ“β”Ο ÷ΡΟΉΓ‘΅ΙήäAΒΡιL±ζ���Θ§≤Μ“ΣΑ―Ρ¥÷ΗΑ¥‘ΎΕΧ±ζ…œ����ΓΘ
9.Ϋo‘΅ΙήάοΒΡΙΧσwΥéΤΖΦ”üαïrëΣ(y®©ng)ΉΔ“β–© ≤Ο¥?
Ϋo‘΅ΙήάοΒΡΙΧσwΥéΤΖΦ”üαïrΘ§ΆυΆυ”–Υ°Τϊ°a(ch®Θn)…ζ(Ζ¥ëΣ(y®©ng)Ώ^≥Χ÷–…ζ≥…ΒΡΥ°ΜρΥéΤΖ÷–ΒΡùώ¥φΥ°)�����Θ§“ρ¥Υ‘΅ΙήΩΎ±ΊμöΈΔœρœ¬ÉA–±(»γàDΥυ Ψ)����ΓΘ
Φ”üα«Α–ηœ»¨Δ‘΅ΙήΆβ±Ύ≤ΝΗ…Θ§“‘Ζά÷ΙΦ”üαïr‘΅Ιή’®Ν―���ΓΘΦ”üαïrëΣ(y®©ng)œ» Ι‘΅ΙήΨυ³ρ ήüα��Θ§ Ι‘΅Ιή‘ΎΨΤΨΪüτ…œ“Τ³”����ΓΘ
»γΙϊ‘΅Ιή“―ΙΧΕ®‘ΎηFΦή≈_…œΘ§³tΩ…”Ο ÷≥÷ΨΤΨΪüτ‘Ύ‘΅Ιήœ¬“Τ³”Θ§“‘±ΘΉC‘΅Ιή ήüαΨυ³ρΓΘ
¥ΐ‘΅ΙήΨυ³ρ ήüαΚσ���Θ§¨ΔΨΤΨΪüτΜπ―φΙΧΕ®‘Ύ‘΅Ιή÷–Ζ≈”–ΙΧσwΥéΤΖΒΡ≤ΩΈΜΘ§ ΙΙΧσwΥéΤΖ≥δΖ÷ ήüα����Θ§“‘άϊ”ΎΖ¥ëΣ(y®©ng)ΒΡμ‰άϊΏM(j®§n)––���ΓΘ
‘Ύ’ϊ²ÄΦ”üαΏ^≥Χ÷–����Θ§≤Μ“Σ Ι‘΅ΙήΗζüτ–ΨΫ””|Θ§“‘Οβ‘΅Ιή’®Ν―��ΓΘ
Ϋo‘΅ΙήάοΒΡ“ΚσwΥéΤΖΦ”üαïrëΣ(y®©ng)ΉΔ“β–© ≤Ο¥?
Ϋo‘΅ΙήάοΒΡ“ΚσwΥéΤΖΦ”üαïr�Θ§“Σ”Ο‘΅ΙήäAäAΉΓ‘΅ΙήΘ§Μρ?q®±)Δ‘΅Ιή”ΟηFäAΙΧΕ®‘ΎηFΦή≈_…œ»γàDΥυ Ψ����ΓΘ
‘΅Ιή÷–“ΚσwΥéΤΖΒΡσwΖe≤Μ“Σ≥§Ώ^‘΅Ιή»ίΖeΒΡ»ΐΖ÷÷°“ΜΘ§“‘Ζά‘ΎΦ”üαΏ^≥Χ÷–Μρ“ΚσwΖ–ρvïr���Θ§”–“ΚσwΥéΤΖèΡ‘΅Ιή÷–“ί≥ω�����ΓΘ
Φ”üα«Α–ηœ»¨Δ‘΅ΙήΆβ±Ύ≤ΝΗ…Θ§“‘ΖάΦ”üαïr‘΅Ιή’®Ν―ΓΘ
Φ”üαïr��Θ§‘΅Ιή“ΣÉA–±�����Θ§ÉA–±Ϋ«Ε»ëΣ(y®©ng)ûι≈cΉάΟφ≥…45°Ϋ«ûιΏm“ΥΓΘ
Φ”üαïrΘ§ëΣ(y®©ng)œ» Ι‘΅ΙήΨυ³ρ ήüαΘ§»ΜΚσ–Γ–ΡΒΊΫo‘΅ΙήάοΒΡ“ΚσwΒΡ÷–œ¬≤ΩΈΜΦ”üαΘ§≤Δ«“≤ΜïrΒΊ…œœ¬“Τ³”‘΅Ιή�ΓΘ°î(d®Γng)‘΅Ιή±ΜΙΧΕ®‘ΎηFΦή≈_…œ��Θ§³t ÷≥÷ΨΤΨΪüτ���Θ§‘Ύ‘΅Ιή ΔΖ≈“ΚσwΒΡ÷–œ¬≤ΩΈΜΧé���Θ§≤ΜïrΒΊ…œœ¬“Τ³”ΨΤΨΪüτ����ΓΘ
‘Ύ’ϊ²ÄΦ”üαΏ^≥Χ÷–���Θ§≤Μ“Σ Ι‘΅ΙήΗζüτ–ΨΫ””|Θ§“‘Οβ‘΅Ιή’®Ν―�����ΓΘ
ûι±ήΟβ‘΅Ιήάο“ΚσwΖ–ρv΅ä≥ω²ϊ»Υ�����Θ§Φ”üαïr«–≤ΜΩ… Ι‘΅ΙήΩΎ¨Π÷χΉ‘ΦΚΜρ≈‘»Υ�����ΓΘ
10.ΡΡ–©εe’`ΒΡ≤ΌΉςΡή¨ß(d®Θo)÷¬‘΅Ιή’®Ν―?
”–“‘œ¬Ψ≈ΖNεe’`���ΓΘ
(1)äA≥÷‘΅ΙήΒΡηFäAΏ^Ψo���Θ§Έ¥Ντ≥ω‘΅Ιή ήüα≈ρΟ¦ΒΡ”ύΒΊΘ§ Ι‘΅Ιή ήüα≈ρΟ¦Αl(f®Γ)…ζ’®Ν―���ΓΘ
(2)‘΅ΙήΆβ±Ύ”–Υ°Έ¥≤ΝΗ…���ΓΘ°î(d®Γng)Φ”üαïr‘΅ΙήΆβ±Ύ”–ΒΡΒΊΖΫœ»Η…‘ο�Θ§”–ΒΡΒΊΖΫΚσΗ…‘ο���Θ§”…”Ύ ήüα≤ΜΨυ³ρ���Θ§Εχ“ΐΤπ‘΅Ιή’®Ν―ΓΘ
(3)Ϋo‘΅Ιή÷–ΒΡΙΧσwΥéΤΖΦ”üαïr���Θ§‘΅ΙήΩΎ¦]…‘œρœ¬ÉA–±Θ§”…”ΎΖ¥ëΣ(y®©ng)Ώ^≥Χ÷–”–Υ°…ζ≥…Μρ‘≠¹μΙΧσwΥéΤΖ÷–Κ§”–ùώ¥φΥ°ΒΡΨâΙ ��Θ§Υ°èΡ‘΅ΙήΩΎΝςœρ‘΅ΙήΒΉΕχ“ΐΤπ‘΅Ιή’®Ν―�ΓΘ
(4)Ϋo‘΅Ιή÷–ΒΡ“ΚσwΦ”üαïrΘ§‘΅Ιή÷–ΒΡ“Κσw≥§Ώ^‘΅Ιή»ίΖeΒΡ»ΐΖ÷÷°“Μ�����Θ§Φ”üαΏ^≥Χ÷–”–“ΚσwèΡ‘΅Ιή÷–“ί≥ωΕχûΔ‘Ύ‘΅ΙήΆβ±ΎΕχ“ΐΤπ‘΅Ιή’®Ν―����ΓΘ
( 5)Ϋo‘΅ΙήΦ”üαïrΘ§¦]œ»Ϋo’ϊ²Ä‘΅ΙήΨυ³ρ ήüα�����Θ§Εχ «÷±Ϋ”Ϋo‘΅Ιή÷–ΒΡΖ≈ΥéΤΖ≤ΩΖ÷ΒΡ‘΅ΙήΧéΦ”üαΘ§Εχ“ΐΤπ‘΅Ιή’®Ν―�ΓΘ
(6)Ϋo‘΅ΙήΦ”üαïrΘ§ΨΤΨΪüτΒΡ―φ–Ρ≈c‘΅ΙήΫ””|��Θ§Εχ“ΐΤπ‘΅Ιή’®Ν―�����ΓΘ
(7)üΐΒΟΚήüαΒΡ‘΅ΙήΖ≈‘ΎΉάΉ”…œΜρ‘΅ΙήΦή…œΕχ“ΐΤπ‘΅Ιή’®Ν―�ΓΘ
(8)¨çρûΏ^≥Χ÷–”–άδΒΡ“ΚσwûRΒΫ±ΜΦ”üαΒΡ‘΅Ιή…œΜρüΐΒΟΚήüαΒΡ‘΅ΙήΏÄΈ¥άδÖsΘ§»γ”ΟάδΥ°¦_œ¥ΚήΩ…Ρή≥ω§F(xi®Λn)’®Ν―��ΓΘ
(9)‘Ύ÷Τ»Γöβσwïr���Θ§”Ο≈≈Υ°»ΓöβΖ® ’Φ·öβσw��Θ§°î(d®Γng)öβσw ’Φ·Άξ°ÖΚσ���Θ§¦]”–Α―¨ß(d®Θo)öβΙήèΡΥ°≤έ÷–ΡΟ≥ω¹μΘ§±ψœ»≥ΖΉΏΨΤΨΪüτ����Θ§ ΙάδΥ°―Ί¨ß(d®Θo)öβΙήΏM(j®§n)»κ‘΅ΙήÉ»(n®®i)�Θ§ïΰ“ΐΤπ‘΅Ιή’®Ν―��ΓΘ
“ΐ…ξΘΚ‘ΎàD1Ϋo“ΚσwΦ”üα―b÷Ο÷–”–ΡΡ–©εe’`?
àD÷–Ι≤”–ΥΡΧéεe’`�ΓΘ
(1)‘΅Ιή÷–ΒΡ“ΚσwΏ^ΕύΓΘ‘΅Ιή÷–ΒΡ“ΚσwΉνΕύûι‘΅Ιή»ίΖeΒΡ»ΐΖ÷÷°“Μ��ΓΘ
(2)‘΅Ιή≤ΜëΣ(y®©ng)ûιΊQ÷±ΖΫœρ��ΓΘ‘΅ΙήëΣ(y®©ng)≈cΉάΟφ≥…45Ε»Ϋ«�ΓΘ
(3)ΨΤΨΪüτÉ»(n®®i)ΨΤΨΪΝΩΧΪΕύΓΘΨΤΨΪüτÉ»(n®®i)ΨΤΨΪΒΡΝΩ≤ΜëΣ(y®©ng)≥§Ώ^»ίΖeΒΡ»ΐΖ÷÷°Εΰ��ΓΘ
(4)‘΅ΙήΒΉ“―Ϋ¦(j®©ng)Ϋ””|ΨΤΨΪüτΒΡüτ–Ψ�Θ§Ώ@‰”‘΅Ιή»ί“Ή’®Ν―ΓΘëΣ(y®©ng)‘™”ΟΨΤΨΪüτΒΡΆβ―φΫo‘΅ΙήΦ”üα�ΓΘ
’ΐ¥_àD–Έ“äàD2����ΓΘ
11.”ΟΝΩΆ≤ΝΩ»Γ“ΜΕ®σwΖeΒΡ“ΚσwïrëΣ(y®©ng)ΉΔ“β–© ≤Ο¥?
”ΟΝΩΆ≤ΝΩ»Γ“ΜΕ®σwΖeΒΡ“ΚσwïrΘ§”–“‘œ¬ΥΡϋcëΣ(y®©ng)‘™ΉΔ“β(»γàDΥυ Ψ)�����ΓΘ
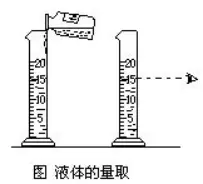
(1)”ΟΝΩΚÜΝΩ»Γ“ΜΕ®σwΖeΒΡ“ΚσwΥéΤΖïr���Θ§ΝΩΆ≤±ΊμöΖ≈ΤΫΖÄ(w®ßn)��ΓΘ
(2)”Ο‘΅³©ΤΩΆυΝΩΆ≤÷–ÉAΒΙ“Κσwïr���Θ§ΤΩΩΎ“ΣΨoΑΛΝΩΆ≤ΩΎ���Θ§ Ι“Κσw―Ί÷χΝΩΆ≤É»(n®®i)±ΎΨèΨèœρœ¬Νς»κΝΩΆ≤÷–ΓΘ
(3)”ΟΡzν^ΒΈΙήΆυΝΩΆ≤É»(n®®i)ΒΈΦ”“Κσwïr����Θ§≤Μ“ΣΑ―Ρzν^ΒΈΙή…λ»κΝΩΆ≤É»(n®®i)Θ§Ηϋ≤Μ‘SΫ””|Ά≤±Ύ��ΓΘ
(4)Ήx»Γ“ΚσwσwΖeîΒ(sh®¥)ïr�Θ§±Ίμö Ι“ïΨÄ≈cΝΩΆ≤É»(n®®i)“ΚσwΒΡΑΦ“ΚΟφΒΡΉνΒΆΧé±Θ≥÷Υ°ΤΫΘ§‘ΌΉx≥ω“ΚσwΒΡσwΖeîΒ(sh®¥)�ΓΘ
12. Ι”ΟΆ–±PΧλΤΫ÷°«Α±ΊμöΉωΡΡ–©€ (zh®≥n)²δΙΛΉς?
Ι”ΟΆ–±PΧλΤΫ÷°«Α±ΊμöΒΡ€ (zh®≥n)²δΙΛΉς «’{(di®Λo)ΝψϋcΓΘΦ¥ΖQΝΩ«Αœ»Α―”Έ¥aΖ≈‘ΎΩΧΕ»≥ΏΒΡΝψΧé�Θ§ôz≤ιΧλΤΫΒΡî[³” «ΖώΏ_(d®Δ)ΒΫΤΫΚβΓΘ»γΙϊ“―ΒΫΏ_(d®Δ)ΤΫΚβ���Θ§÷Ηα‰î[³”ïrœ»Κσ÷Η ΨΒΡ‰Υ(bi®Γo)≥Ώ…œΒΡΉσ��ΓΔ”“É…ΏÖΒΡΗώîΒ(sh®¥)Ϋ”ΫϋœύΒ»�Θ§÷Ηα‰λo÷ΙïrëΣ(y®©ng)÷Η‘Ύ‰Υ(bi®Γo)≥ΏΒΡ÷–ιgΓΘ»γΙϊΧλΤΫΒΡî[³”Έ¥Ώ_(d®Δ)ΒΫΤΫΚβ�Θ§Ω…“‘’{(di®Λo)Ιù(ji®Π)ΉσΓΔ”“ΒΡ¬ίΫz�Θ§ Ιî[³”Ώ_(d®Δ)ΒΫΤΫΚβΓΘ
13.àD1Ώ^ûV―b÷Ο÷–”–ΡΡ–©εe’`?
àD÷–Ι≤”–ΥΡΧéεe’`��ΓΘ
(1)ûVΦàΏ^¥σ���ΓΘûVΦà≤ΜëΣ(y®©ng)≥§≥ω¬©ΕΖΩΎ“‘Άβ��Θ§ûVΦàΒΡΏÖΨâ“ΣΒΆ”Ύ¬©ΕΖΩΎΦs5mm�Θ§Εύ”ύΒΡûVΦàëΣ(y®©ng)Φτ»Ξ�ΓΘ
(2)≤ΘΝßΑτë“Ω’ΝΥΘ§Έ¥”|ΦΑûVΦà���ΓΘ≤ΘΝßΑτëΣ(y®©ng)”|ΦΑûVΦà»ΐ’έΒΡΡ«“ΜΏÖ��ΓΘ
(3)ÉAΒΙïrΏ^ûV“ΚσwΒΡüΐ±≠ΩΎëΣ(y®©ng)Ϋ””|≤ΘΝßΑτ≤≈¨ΠΓΘ
(4)¬©ΕΖΉλΒΡΦβν^≤ΩΖ÷Έ¥Ϋ””|üΐ±≠É»(n®®i)±Ύ�ΓΘëΣ(y®©ng)¨Δ¥Υ¬©ΕΖΥ°ΤΫΒΊ–ΐόD(zhu®Θn)“ΜΑΌΑΥ °Ε»Θ§ Ι¬©ΕΖΉλΒΡΦβν^≤ΩΖ÷Ϋ””|üΐ±≠É»(n®®i)±Ύ�ΓΘ’ΐ¥_àD–Έ“äàD2ΓΘ
14.‘Ύ»ή³©σwΖe“ΜΕ®ΒΡ½lΦΰœ¬Θ§‘艔֔ռΙΧσwΈοΌ|(zh®§)ΒΡ»ήΫβ?
“ΜΑψ≥Θ”ΟΒΡ”–œ¬ΟφΒΡΥΡΖNΖΫΖ®�ΓΘ
(l)¨ΔΙΧσw»ήΌ|(zh®§)―–ΡΞ≥…Φö(x®§)ΒΡΖέΡ©ΓΘΙΧσw»ήΌ|(zh®§)ΒΡνwΝΘ‘Ϋ–Γ��Θ§ΥϋΗζ»ή³©Ϋ””|ΒΡΟφΖeΨΆ‘Ϋ¥σ����ΓΘΨΆ‘Ϋ»ί“Ή»ήΫβΓΘ“ρ¥Υ�����Θ§‘ΎΙΧσw»ήΌ|(zh®§)Έ¥Ζ≈»κ»ή³©÷–“‘«Α��Θ§œ»¨Δ¥σνwΝΘΒΡΙΧσw»ήΌ|(zh®§)Ζ≈‘Ύ―–άè÷–―–ΡΞ��Θ§¥ΐ―–≥…Φö(x®§)ΒΡΖέΡ©“‘Κσ�����Θ§‘ΌΖ≈»κ»ή³©÷°÷–�Θ§Ώ@‰”Ω… Ι»ήΫβΒΡΥΌ¬ Φ”ΩλΓΘ
(2)’ώ é�����ΓΘ»γΙϊ «‘Ύ‘΅Ιή÷–ΏM(j®§n)––…ΌΝΩΙΧσw»ήΌ|(zh®§)ΒΡ»ήΫβïrΘ§Ω…“‘”Ο’ώ éΒΡΖΫΖ®����Θ§Φ”ΥΌΙΧσw»ήΌ|(zh®§)ΒΡ»ήΫβΓΘ
(3)î΅Αη���ΓΘ»γΙϊ «‘Ύüΐ±≠÷–ΏM(j®§n)––ί^ΕύΝΩΙΧσw»ήΌ|(zh®§)ΒΡ»ήΫβïr����Θ§”Ο≤ΘΝßΑτ≤ΜîύΒΊî΅Αη»ή“Κ�Θ§Ω…“‘Φ”ΥΌΙΧσwΈοΌ|(zh®§)ΒΡ»ήΫβΓΘ
(4)Φ”üα�����ΓΘΦ”üαïrΩ…“‘‘ωΦ”Ζ÷Ή”Ώ\(y®¥n)³”ΒΡΥΌ¬ �����ΓΘΝμΆβ��Θ§Ϋ^¥σΕύîΒ(sh®¥)ΙΧσwΈοΌ|(zh®§)ΒΡ»ήΫβΕ» «κS÷χ€ΊΕ»ΒΡ…ΐΗΏΕχ‘ω¥σΒΡ�����ΓΘ“ρ¥ΥΦ”üαïr“≤Ω…“‘ ΙΙΧσwΈοΌ|(zh®§)»ήΫβΕ»‘ω¥σ����Θ§»ήΫβΥΌ¬ “≤Φ”ΩλΝΥΓΘ
15.ΜλΚœΈοΖ÷κxΒΡΖΫΖ®”–ΡΡéΉΖN?
ΜλΚœΈοΖ÷κxΒΡΖΫΖ®”–Ώ^ûVΖ®�ΓΔ’τΑl(f®Γ)Ζ®ΓΔ’τπsΖ®�����ΓΔΖ÷“ΚΖ®���ΓΔΫY(ji®Π)ΨßΖ®Β»ΈεΖN��ΓΘ
16. ≤Ο¥νê–ΆΒΡΜλΚœΈο≤…”ΟΏ^ûVΖ®Ζ÷κx?
Ώ^ûV «Α―≤Μ»ή”Ύ“ΚσwΒΡΙΧσwΈοΌ|(zh®§)Ηζ“ΚσwΖ÷κxïr≤…”ΟΒΡ“ΜΖNΖΫΖ®�ΓΘ»γ¥÷ϊ}ΒΡΧαΦÉ�����Θ§ Ήœ»ΨΆ «Α―¥÷ϊ}»ή”ΎΥ°��Θ§Ϋ¦(j®©ng)Ώ^Ώ^ûV��Θ§Α―≤Μ»ή”ΎΥ°ΒΡΡύΆΝΒ»ΙΧσwκsΌ|(zh®§)Ηζ ≥ϊ}Υ°Ζ÷κx��ΓΘ
17.‘艔―b²δΏ^ûVΤς?
»γàDΥυ ΨΓΘ
»Γ“ΜèààA–ΈûVΦà(àDA)�Θ§œ»’έ≥…ΑκàA(àDB)Θ§‘Ό’έ≥…ΥΡΒ»Ζ÷(àDC)����Θ§»ΜΚσ¥ρι_ Ι÷°≥…ûιàAεF–ΈΘ§Α―àAεF–ΈΒΡûVΦàΦβΕΥ≤ΩΖ÷œρœ¬���Θ§Ζ≈»κ¬©ΕΖάο���Θ§ûVΦàΒΡΏÖΨâëΣ(y®©ng)±»¬©ΕΖΩΎ…‘ΒΆΘ§ΦsΒΆ5mmΉσ”“���Θ§Α―Εύ”ύΒΡûVΦàΦτ»Ξ���ΓΘ»ΜΚσ”Ο ÷âΚΉΓûVΦàΘ§”ΟΥ°ùôùώûVΦà��Θ§ ΙûVΦàΨoΌN¬©ΕΖΒΡÉ»(n®®i)±Ύ���Θ§÷–ιg≤Μ“ΣΝτ”–öβ≈ί��ΓΘΏ@‰”ΨΆΉω≥…“Μ²ÄΏ^ûVΤς����ΓΘ
18.Ώ^ûV≤ΌΉς”–ΡΡ–©“ΣνI(l®Ϊng)?
ûι±ψ”Ύ”¦ë¦Τπ“äΘ§Ώ^ûV≤ΌΉς÷–ΒΡ“ΣνI(l®Ϊng)Ω…Η≈ά®ûιΘΚ“ΜΫ«����ΓΔ“Μî΅�ΓΔ“Μλo÷ΟΓΔΕΰΒΆ����ΓΔ»ΐΫ””|ΓΘ
“ΜΫ«ΘΚ «÷ΗûVΦà’έ·BïrΒΡΫ«Ε»“Σ≈c¬©ΕΖΒΡΫ«Ε»œύ“Μ÷¬����ΓΘΏ@‰”ΦτΧαΒΡûVΦàΘ§≤≈ΡήΨoΌN¬©ΕΖΒΡÉ»(n®®i)±Ύ��Θ§Ώ@‰”≤≈Ρή±ΘΉCΏ^ûVΒΡΥΌ¬ Ωλ����ΓΘ(±±Ψ©ûι“ΜΌN ûVΦàΨoΌN¬©ΕΖÉ»(n®®i)±Ύ)
“Μî΅ΘΚ¨ΔΜλΚœΈοΒΙ»κΥ°÷–“‘ΚσΘ§”Ο≤ΘΝßΑτî΅Αη��Θ§Ω…“‘Φ”ΩλΤδ÷–Ω…»ή–‘ΈοΌ|(zh®§)ΒΡ»ήΫβΥΌ¬ ��ΓΘ
“Μλo÷ΟΘΚ¥ΐΩ…»ή–‘ΈοΌ|(zh®§)Άξ»Ϊ»ήΫβΚσ����Θ§≤Μ“ΣΝΔΦ¥ΨΆΏM(j®§n)––Ώ^ûVΘ§“Σλo÷ΟΤ§ΩΧ���ΓΘΡΩΒΡ « Ι≤Μ»ή–‘ΈοΌ|(zh®§)ΒΡνwΝΘœ»≥ΝΒμ≥ω“Μ≤ΩΖ÷�Θ§Ώ@‰”ΉωΩ…“‘€p…ΌΜρΖά÷Ι≤Μ»ή–‘ΈοΌ|(zh®§)¨ΔûVΦà…œΒΡΈΔ–ΓΩΉœΕΕ¬»ϊΘ§èΡΕχΦ”ΩλΏ^ûVΒΡΥΌ¬ ��ΓΘ
ΕΰΒΆΘΚ÷ΗΒΡ «ûVΦàΒΡΏÖΨâ“Σ…‘ΒΆ”Ύ¬©ΕΖΒΡΏÖΨâ;‘Ύ’ϊ²ÄΏ^ûVΏ^≥Χ÷–ΏÄ“Σ ΦΫKΉΔ“βΒΫûV“ΚΒΡ“ΚΟφ“ΣΒΆ”ΎûVΦàΒΡΏÖΨâΓΘΖώ³tΒΡ‘£�Θ§±ΜΏ^ûVΒΡ“ΚσwïΰèΡûVΦà≈c¬©ΕΖ÷°ιgΒΡιgœΕΝςœ¬��Θ§÷±Ϋ”ΝςΒΫ¬©ΕΖœ¬ΏÖΒΡΫ” ήΤς÷–��Θ§Ώ@‰”Έ¥Ϋ¦(j®©ng)Ώ^ûVΒΡ“Κσw≈cûV“ΚΜλ‘Ύ“ΜΤπ����Θ§Εχ ΙûV“Κ€ÜùαΘ§¦]”–Ώ_(d®Δ)ΒΫΏ^ûVΒΡΡΩΒΡ����ΓΘ
»ΐΫ””|ΘΚ“Μ «÷Η Δ”–¥ΐΏ^ûVΒΡ“ΚσwΒɻꬩΕΖ÷–ïrΘ§“Σ Ι Δ”–¥ΐΏ^ûV“ΚσwΒΡüΐ±≠ΒΡüΐ±≠Ήλ≈cÉA–±ΒΡ≤ΘΝßΑτœύΫ””|�ΓΘΕΰ «÷Η≤ΘΝßΑτΒΡœ¬ΕΥ“Σ≈cûVΦàûι»ΐ¨”ΒΡΡ«“ΜΏÖœύΫ””|��ΓΘ»ΐ «÷Η¬©ΕΖΒΡνi≤Ω“Σ≈cΫ” ’ûV“ΚΒΡΫ” ήΤςΒΡÉ»(n®®i)±ΎœύΫ””|��ΓΘ
19.”ΟΏ^ûVΖ®ΧαΦÉΈοΌ|(zh®§)ïr��Θ§ΟΩ≤Ϋ≤ΌΉςΒΡΡΩΒΡ « ≤Ο¥?
‘ΎΏ^ûVΖ®÷–Έε≤Ϋ≤ΌΉςΒΡΡΩΒΡΖ÷³eîΔ ω»γœ¬ΘΚ
»ήΫβΘΚ ΙΜλΚœΈο÷–ΒΡΩ…»ή–‘ΈοΌ|(zh®§)»ήΫβ�����ΓΘ
Ώ^ûVΘΚ ΙΜλΚœΈο÷–ΒΡΩ…»ή–‘ΈοΌ|(zh®§)≈c≤Μ»ή–‘ΈοΌ|(zh®§)Ζ÷κx��Γ�ΘΩ…»ή–‘ΈοΌ|(zh®§)‘ΎûV“Κ÷–��Θ§≤Μ»ή–‘ΈοΌ|(zh®§)Ντ‘ΎûVΦà…œ�ΓΘœ¥€λ≥ΝΒμΘΚ ΙΩ…»ή–‘ΈοΌ|(zh®§)±MΝΩΉωΒΫ»Ϊ≤ΩûV≥ω÷ΝûV“Κ÷–ΓΘ ΙΩ…»ή–‘ΈοΌ|(zh®§)≈c≤Μ»ή–‘ΈοΌ|(zh®§)Ζ÷κxΒΡΆξ»Ϊ���ΓΘ
’τΑl(f®Γ)ΘΚ ΙΩ…»ή–‘ΈοΌ|(zh®§)èΡûV“Κ÷–Έω≥ω����ΓΘ
œ¥€λΨßσwΘΚ”ΟΥ°(ΉνΚϔϒτπsΥ°)¦_œ¥ΒτΨßσw±μΟφΒΡκsΌ|(zh®§)Θ§“‘ ΙΥυΒΟΒΡΨßσwΈοΌ|(zh®§)ΗϋΦÉÉτ���ΓΘ
20. ≤Ο¥νê–ΆΒΡΜλΚœΈο”Ο’τΑl(f®Γ)Ζ®Ζ÷κx?
’τΑl(f®Γ)Ζ® «Α―Ρή»ή”ΎΥ°ΒΡΙΧσwΈοΌ|(zh®§)ΗζΥ°Ζ÷κxïr≤…”ΟΒΡ“ΜΖNΖΫΖ®��ΓΘ(»γ¥÷ϊ}ΒΡΧαΦɨçρû÷–��Θ§Ϋ¦(j®©ng)Ώ^ûVΚσΥυΒΟΒΡ≥Έ«εΆΗΟςΒΡ ≥ϊ}Υ°ΨΆ «≤…”Ο’τΑl(f®Γ)Ζ®��Θ§¨ΔΥ°’τΑl(f®Γ)Βτ“‘Κσ��Θ§ΒΟΒΫΦÉÉτΒΡΙΧσw ≥ϊ}ΒΡ)�ΓΘΝμΆβ��Θ§‘ΌΑ―œΓ»ή“ΚùβΩsïr�Θ§≤…”ΟΒΡ“≤ «’τΑl(f®Γ)Ζ®ΓΘ÷Μ «¨ΔΥ°’τΑl(f®Γ)Βτ“Μ≤ΩΖ÷Εχ ΙœΓ»ή“ΚΉÉ?y®≠u)ιùβ»ή“ΚΒΡΓ?/p>
21. ≤Ο¥νê–ΆΒΡΜλΚœΈο”Ο’τπsΖ®Ζ÷κx?
’τπsΖ® «Ζ÷κxΚΆΧαΦÉ±Υ¥ΥΜΞœύΡή“‘»Έ“β±»άΐΜΞ»ήΒΡ“ΚσwΗζ“ΚσwΒΡΜλΚœΈοïr≥Θ”ΟΒΡ“ΜΖNΖΫΖ®���ΓΘ «Ηυ™ΰ(j®¥)≤ΜΆ§“ΚσwΈοΌ|(zh®§)Ζ–ϋcΗΏΒΆΒΡ≤ΜΆ§�Θ§¨ΔΥϋ²ÉΖ÷κxΧαΦÉΒΡ“ΜΖNΖΫΖ®�ΓΘ‘ΎΦ”üαïrΘ§Ζ–ϋcΒΆΒΡ“Κσwœ»ΤϊΜ·Θ§Ϋ¦(j®©ng)Ώ^άδΡΐΤςάδΡΐΚσ��Θ§œ»άδΡΐ≥…ûι“Κσw���ΓΘΕχΖ–ϋcΗΏΒΡ“ΚσwκyΤϊΜ·�Θ§³tΝτ‘Ύ’τπsüΐΤΩ÷–��ΓΘëΣ(y®©ng)”ΟΏ@“ΜΖΫΖ®ΨΆΩ…“‘Α―±Υ¥ΥΜΞœύΡή“‘»ΈΚΈ±»άΐΜΞ»ήΒΡ“ΚσwΗζ“ΚσwΒΡΜλΚœΈοΏM(j®§n)––Ζ÷κx��ΓΘΝμΆβ�Θ§°î(d®Γng)“Κσw÷–»ήΫβ”–Ρ≥ΖNΙΧσwΈοΌ|(zh®§)ïrΘ§ûιΪ@ΒΟΦÉÉτΒΡ“Κσw��Θ§ΕχΑ―»ήΫβ‘ΎΤδ÷–ΒΡΙΧσwΈοΌ|(zh®§)≥ΐ»Ξïr��Θ§“≤≤…”Ο’τπsΖ®��ΓΘ“ρûιΦ”üαΒΡ½lΦΰœ¬�Θ§“Κσw ήüαΉÉ≥…’τΤϊ�Θ§èΡ’τπsüΐΤΩ÷–≥ω¹μΘ§Ϋ¦(j®©ng)Ώ^άδΡΐΤςΚσάδΡΐ≥…ûι“Κσw��Θ§±ψΒΈ‘ΎΫ” ήΤς÷–�����Θ§‘≠¹μ»ήΫβ‘Ύ“Κσw÷–ΒΡΈοΌ|(zh®§)³tΝτ‘Ύ’τπsüΐΤΩ÷–ΓΘ÷Τ»Γ’τπsΥ°Β»ΨΆ «”Ο’τπsΒΡΖΫΖ®(»γàDΥυ Ψ)�����ΓΘ
22.»γΚΈôzρûöβσwΑl(f®Γ)…ζ―b÷Ο «Ζώ¬©öβ?
‘Ύ¨çρû “άο÷Τ»Γ―θöβ��ΓΔöδöβ�ΓΔΕΰ―θΜ·ΧΦΒ»öβσwïrΕΦ±Ίμöôz≤ι―b÷ΟΒΡöβΟή–‘ «ΖώΆξΚΟΘ§÷Μ”–―b÷Ο≤Μ¬©öβïr≤≈Ρή Ι”Ο�����ΓΘ
“Σôz≤ι―b÷Ο «Ζώ¬©öβ����Θ§ëΣ(y®©ng)Α―¨ß(d®Θo)öβΙήΒΡ“ΜΕΥΫΰ»κüΐ±≠ΜρΥ°≤έΒΡΥ°÷–Θ§”Ο ÷ΨoΈ’‘΅ΙήΜρ”Ο ÷’ΤΨoΌNüΐΤΩΒΡΆβ±Ύ�����ΓΘ»γΙϊ―b÷Ο≤Μ¬©öβ�Θ§‘΅ΙήΜρüΐΤΩάοΒΡΩ’öβ ήüα≈ρΟ¦Θ§¨ß(d®Θo)ΙήΩΎΨΆ”–öβ≈ίΟΑ≥ω(»γàD1Υυ Ψ)����ΓΘ
»ΜΚσΑ― ÷“Τι_����Θ§Ώ^“ΜïΰÉΚ���Θ§¥ΐ‘΅ΙήΜρüΐΤΩάδÖsΚσ��Θ§Υ°ΨΆèΡüΐ±≠ΜρΥ°≤έ÷–…ΐΒΫ¨ß(d®Θo)öβΙήάο��Θ§–Έ≥…“ΜΕΈΥ°÷υ��Θ§³t±μΟς―b÷Ο≤Μ¬©öβ(»γàD2Υυ Ψ)�����ΓΘ
»γΙϊΑl(f®Γ)§F(xi®Λn)―b÷Ο¬©öβ��Θ§±Ίμö’“≥ω¬©öβΒΡ‘≠“ρΘ§≤ΔΏM(j®§n)––’{(di®Λo)’ϊ�ΓΔ–όάμΜρΗϋ™QΝψΦΰΓΘ‘Ό¥Έôzρû����Θ§÷±÷Ν―b÷Ο≤Μ¬©öβïr≤≈ΡήΏM(j®§n)––¨çρû�ΓΘ

23.¨çρû “‘艔 ’Φ·Εΰ―θΜ·ΧΦ?
¨çρû “÷Τ»ΓΕΰ―θΜ·ΧΦ?x®§)βσw≤ΜΡή”Ο≈≈Υ°»ΓöβΖ® ’Φ·��Θ§”…”ΎΕΰ―θΜ·ΧΦΡή»ή”ΎΥ°�Θ§ΒΪΡήâρ”Ο≈≈Ω’öβ»ΓöβΖ® ’Φ·ΓΘ”…”ΎΕΰ―θΜ·ΧΦ±»Ω’öβ÷Ί��Θ§ ’Φ·ïrΦ·öβΤΩΩΎëΣ(y®©ng)≥·…œ�Θ§≤…”Οœρ…œ≈≈Ω’öβ»ΓöβΖ®¨ΔΕΰ―θΜ·ΧΦ ’Φ·‘ΎΦ·öβΤΩάοΓΘ”Ο»Φ÷χΒΡΜπ≤ώΖ≈‘ΎΦ·öβΤΩΩΎ‘΅ρû�Θ§»γΙϊΜπ―φœ®€γΘ§³tΉCΟςΦ·öβΤΩάο“―≥δùMΝΥΕΰ―θΜ·ΧΦ��ΓΘ
24.‘艔ôzρû“Μ―θΜ·ΧΦ»ΦüΐΒΡ°a(ch®Θn)Έο?
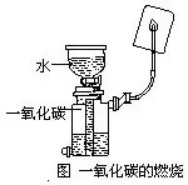
»γàDΥυ Ψϋc»Φ“Μ―θΜ·ΧΦ���Θ§ΥϋΩ’öβάο»ΦüΐïrΒΡΜπ―φ «Υ{(l®Δn)…ΪΒΡ�����ΓΘ“Μ―θΜ·ΧΦ»ΦüΐΚσΒΡ…ζ≥…Έο «Εΰ―θΜ·ΧΦ?x®§)βσw�ΓΘΕΰ―θΜ·ΧΦ≈cüΐ±≠É»(n®®i)±Ύ≥Έ«εΒΡ ·Μ“Υ°Ής”Ο�Θ§…ζ≥…≤Μ»ή”ΎΥ°ΒΡΧΦΥαβ}Θ§ ·Μ“Υ°ΉÉ€Üùα��ΓΘ
Ζ¥ëΣ(y®©ng)»γœ¬ΘΚ
2CO+O2=2CO2
CO2+Ca(OH)2=CaCO3↓+H2O
25. ≤Ο¥Ϋ–ΈοΌ|(zh®§)ΒΡηb³e?
ηb³eΨΆ «Ηυ™ΰ(j®¥)éΉΖN≤ΜΆ§ΈοΌ|(zh®§)–‘Ό|(zh®§)ΒΡ≤ΜΆ§ΦΑ”–ξP(gu®Γn)¨çρû§F(xi®Λn)œσΒΡ≤ΜΆ§����Θ§¨ΔΥϋ²É“Μ“ΜÖ^(q®±)³eι_���ΓΘ
Ϋ¦(j®©ng)≥Θ”ωΒΫΒΡΈοΌ|(zh®§)ηb³e”–öβσwηb³e;ΏÄ”–»ή“ΚΒΡηb³eΘ§“≤Ϋ–κxΉ”ηb³e�ΓΘ
öβσwΒΡηb³e «Ηυ™ΰ(j®¥)öβσw±Ψ…μΒΡΧΊ–‘¹μηb³eΒΡΓΘ»γ”ΟΒΫ―θöβΡή÷ß≥÷»ΦüΐΒΡ–‘Ό|(zh®§)ΦΑΡή Ιéß”–”ύ†aΒΡΡΨ½l÷Ί–¬èΆ(f®¥)»Φ�����Θ§ΜρΡή Ι»Φ÷χΒΡΡΨ½l‘Ϋ÷χ‘ΫΆζΒΡ§F(xi®Λn)œσ¹μηb³e―θöβΒΡ;”ΟöδöβΒΡΩ…»Φ–‘�ΓΔöδöβ»ΦüΐïrΒΡΜπ―φ «Β≠Υ{(l®Δn)…ΪΒΡΘ§öδöβ»ΦüΐΚσΒΡ°a(ch®Θn)Έο÷Μ”–Υ°Ώ@“ΜΖNΈοΌ|(zh®§)Β»ΧΊ’ς¹μηb³eöδöβ;”Ο“Μ―θΜ·ΧΦΒΡΩ…»Φ–‘�ΓΔ“Μ―θΜ·ΧΦ»ΦüΐïrΒΡΜπ―φ «Υ{(l®Δn)…ΪΒΡΘ§“Μ―θΜ·ΧΦ»ΦüΐΚσΒΡ°a(ch®Θn)Έο «Ρή Ι≥Έ«ε ·Μ“Υ°ΉÉ€ÜΒΡΕΰ―θΜ·ΧΦΏ@–©ΧΊ’ς¹μηb³e“Μ―θΜ·ΧΦ;”ΟΒΫΕΰ―θΜ·ΧΦ≤Μ÷ß≥÷»Φüΐ���Θ§Ρή Ι»Φ÷χΒΡΡΨ½lœ®€γ����Θ§Ρή Ι≥Έ«ε ·Μ“Υ°ΉÉ€ÜΒ»ΧΊ’ς¹μηb³eΕΰ―θΜ·ΧΦ?x®§)βσw;”ΟΒΣöβ≤Μ÷ß≥÷»Φüΐ�����Θ§Ρή Ι»Φ÷χΒΡΡΨ½lœ®€γ��Θ§ΒΪ≤ΜΡή Ι≥Έ«ε ·Μ“Υ°ΉÉ€ÜΒ»ΧΊ’ς¹μηb³eΒΣöβ�ΓΘ
ΥαΓΔâA»ή“Κηb³e³t «Ηυ™ΰ(j®¥)Υα����ΓΔâA¨Π÷Η Ψ³©ο@≤ΜΆ§ν¹…Ϊ¹μηb³eΒΡΓΘ
Ag+��ΓΔCl-���ΓΔSO42-����ΓΔCO32-Β»κxΉ”ΒΡηb³e“≤ «Ηυ™ΰ(j®¥)Ώ@–©κxΉ”≈cΡ≥–©‘΅³©Ζ¥ëΣ(y®©ng)ΒΡ≤ΜΆ§§F(xi®Λn)œσ¹μηb³eΒΡ��ΓΘηb³eCl-”ΟΒΫœθΥαψyΚΆœΓœθΥαÉ…ΖN‘΅³©����ΓΘηb³eSO42-”ΟΒΫ¬»Μ·δ^(ΜρœθΥαδ^)ΚΆœΓœθΥαÉ…ΖN‘΅³©ΓΘηb³eCO32-”ΟΒΫèä(qi®Δng)Υα(»γϊ}ΥαΜρœθΥα)ΚΆ ·Μ“Υ°É…ΖN‘΅³©��ΓΘηb³eAg+”ΟΩ…»ή–‘ΒΡϊ}Υαϊ}»ή“Κ(Μρϊ}Υα)ΚΆœΓœθΥαÉ…ΖN‘΅³©��ΓΘ
‘Ύϊ}νêηb³eïr(»γΙϊ «ξéκxΉ”≤ΜΆ§ïr)ηb³eμ‰–ρ“ΜΑψ «œ»ηb³eΧΦΥαϊ}�����Θ§»ΜΚσ‘Όηb³eΝρΥαϊ}ΓΔϊ}Υαϊ}���Θ§°î(d®Γng)ΤδΥϋΥαΗυξéκxΉ”ΕΦηb³eΆξ“‘Κσ����Θ§ Θ”ύΒΡûιœθΥαϊ}���ΓΘ
26.»γΚΈ”ΟΜ·¨W(xu®Π)ΖΫΖ®ηb³e“Μ―θΜ·ΧΦΚΆΕΰ―θΜ·ΧΦ
Ηυ™ΰ(j®¥)“Μ―θΜ·ΧΦ�ΓΔΕΰ―θΜ·ΧΦÉ…ΖNöβσw–‘Ό|(zh®§)ΒΡ≤ΜΆ§ΏM(j®§n)––ηb³e�����Θ§”–“‘œ¬É…ΖNΖΫΖ®��ΓΘ
ΖΫΖ®1ΘΚ»ΓÉ…÷ßùçÉτΒΡ‘΅Ιή�����Θ§άοΏÖΖ÷³eΒΙ»κ…ΌΝΩ≥Έ«εΒΡ ·Μ“Υ°��ΓΘ»ΜΚσ¨ΔÉ…²ÄΌAöβΤΩ÷–ΒΡöβσwΖ÷³eΆ®»κÉ…²Ä‘΅ΙήάοΘ§Τδ÷–“Μ²Ä‘΅ΙήÉ»(n®®i)ΒΡ ·Μ“Υ°ΉÉ€Üùα����Θ§ΉCΟς‘™öβσw «Εΰ―θΜ·ΧΦ�Θ§Νμ“Μ²Ä‘΅ΙήÉ»(n®®i)ΒΡ ·Μ“Υ°≤ΜΉÉΘ§³t‘™öβσw «“Μ―θΜ·ΧΦ�����ΓΘ
CO2+Ca(OH)2=CaCO3↓+H2O
CO≈cCa(OH)2≤ΜΖ¥ëΣ(y®©ng)
ΖΫΖ®2ΘΚ¨ΔÉ…²ÄΌAöβΤΩ¨ß(d®Θo)öβΙήΒΡιyιT(Μν»ϊ)¥ρι_�Θ§”Ο»Φ÷χΒΡΡΨ½lΫ”Ϋϋ¨ß(d®Θo)öβΙήΩΎΓΘΤδ÷–“Μ²ÄöβσwΡή»Φüΐ«“Αl(f®Γ)≥ωΥ{(l®Δn)…ΪΜπ―φΒΡ�Θ§³tΉCΟς‘™öβσwûι“Μ―θΜ·ΧΦ;Νμ“Μ²Ä Ι»Φ÷χΒΡΡΨ½lœ®€γΘ§³t «Εΰ―θΜ·ΧΦ�ΓΘ
2CO+O2=2CO2
27.»γΚΈηb³eöδöβΓΔ“Μ―θΜ·ΧΦ�ΓΔΦΉΆι»ΐΖNüo…Ϊöβσw?
Ζ÷³eϋc»Φ»ΐΖNöβσwΘ§‘Ύ»ΐ²ÄΜπ―φΒΡ…œΖΫΗς’÷“Μ²ÄάδΕχΗ…‘οΒΡüΐ±≠���Θ§Ώ^“ΜïΰÉΚ����Θ§ïΰΩ¥ΒΫ”–É…²Äüΐ±≠ΒΡÉ»(n®®i)±ΎΉÉΒΟΡΘΚΐ≤Δ”–Υ°’τöβΡΐΫY(ji®Π)����Θ§³t’fΟςΏ@É…ΖNöβσw÷–”–“Μ²Ä «öδöβ�����Θ§Νμ“Μ²Ä «ΦΉΆι����ΓΘ‘Ύüΐ±≠É»(n®®i)±Ύ¦]”–Υ°’τöβΡΐΫY(ji®Π)ΒΡΡ«ΖNöβσw“ΜΕ® «“Μ―θΜ·ΧΦ��ΓΘ
‘ΌœρΝμΆβÉ…²Äüΐ±≠É»(n®®i)Ζ÷³eΉΔ»κ…ΌΝΩΒΡ≥Έ«εΒΡ ·Μ“Υ°��Θ§’ώ é�Θ§“ä”– ·Μ“Υ°ΉÉ€ÜΒΡΘ§³t’fΟςΡ«ΖNöβσwûιΦΉΆι���ΓΘ ·Μ“Υ°≤ΜΉÉ€ÜΒΡ��Θ§’fΟςΡ«ΖNöβσwûιöδöβ���ΓΘ
28.”–―θöβΓΔöδöβ�ΓΔΒΣöβΓΔΩ’öβ����ΓΔ“Μ―θΜ·ΧΦ��ΓΔΕΰ―θΜ·ΧΦ6ΖNöβΓΓ σw��Θ§‘艔ηb³eΥϋ²É?
»Γ6÷ß‘΅Ιή����Θ§≤ΔΖ÷³eΒΙ»κ≥Έ«εΒΡ ·Μ“Υ°�ΓΘ»ΜΚσ¨Δ6²ÄΌA¥φöβσwΒΡœπΡz¥ϋ…œΒΡ¨ß(d®Θo)öβΙήΖ÷³e≤ε»κ6²Ä‘΅ΙήΒΡ ·Μ“Υ°÷–�Θ§¥ρι_Ή‘”…äAΘ§”^≤λ6²Ä‘΅Ιή÷– ·Μ“Υ°ΒΡΉÉΜ·��ΓΘΤδ÷–”–“Μ÷ß‘΅Ιή÷–ΒΡ ·Μ“Υ°ΉÉ€Üùα�����Θ§¥ΥΖNöβσw±ΊûιΕΰ―θΜ·ΧΦ�ΓΘΤδΥϋΈε÷ß‘΅Ιή÷–üoΉÉΜ·ΓΘξP(gu®Γn)ι]Ή‘”…äA����ΓΘ
»Γ“Μ²ÄΥ°≤έ≤ΔΖ≈ΚΟΥ°ΓΘ‘Ό»Γ5²ÄΦ·öβΤΩ‘ΎΤδÉ»(n®®i)≤Ω“≤»Ϊ―bùMΥ°≤ΔΒΙΝΔ‘ΎΥ°≤έ÷–��ΓΘ¨Δ Θ”ύΒΡ5ΖNöβσwΨυ≤…”Ο≈≈Υ°»ΓöβΖ®Ης ’Φ·“ΜΦ·öβΤΩöβσwΘ§≤Δ¨Δ¥Υ5ΤΩöβσw”Ο≤ΘΝßΤ§…wΚΟ����Θ§èΡΥ°≤έ÷–»Γ≥ωΘ§Ζ≈÷Ο‘ΎΉάΟφ…œ��ΓΘ
”Ο»Φ÷χΒΡΡΨ½lΖ÷³eΖ≈‘Ύ5²ÄΦ·öβΒΡΤΩΩΎ���Θ§”^≤λ§F(xi®Λn)œσ�ΓΘ
Τδ÷–“ΜΤΩöβσwΡή ΙΡΨ½l‘Ϋ÷χ‘ΫΆζΒΡ�Θ§³t“ΜΕ® «―θöβΓΘ
Τδ÷–“ΜΤΩ¨Π”ΎΡΨ½l»Φüΐ¦] ≤Ο¥”Αμë��Θ§ΕχΤΩ÷–öβσw“≤¦]”–»Φüΐ§F(xi®Λn)œσΒΡΘ§³t“ΜΕ® «Ω’öβΓΘ
Τδ÷–“ΜΤΩΡή Ι»Φ÷χΡΨ½lœ®€γΒΡ“ΜΕ®ûιΒΣöβ��ΓΘ
”–É…ΤΩöβσw‘Ύ”ω»Φ÷χΒΡΡΨ½lïrΘ§ΤΩ÷–ΒΡöβσw±Μϋc»ΦΝΥΘ§«“»ΦüΐïrΒΡΜπ―φΨυûιΒ≠Υ{(l®Δn)…ΪΘ§¥Υïr―ΗΥΌΒΊΆυÉ…²ÄΦ·öβΤΩ÷–ΕΦΒΙ»κ…ΌΝΩΒΡ≥Έ«εΒΡ ·Μ“Υ°���Θ§…w…œ≤ΘΝßΤ§Θ§™u³”Φ·öβΤΩ���Θ§”^≤λ ·Μ“Υ°ΒΡΉÉΜ·�ΓΘΤδ÷–”–“ΜΤΩ÷–ΒΡ ·Μ“Υ°ΉÉ€ÜùαΝΥΘ§³t‘≠¹μΒΡöβσw“ΜΕ®ûι“Μ―θΜ·ΧΦ����Θ§“ρûι“Μ―θΜ·ΧΦ»ΦüΐΚσ…ζ≥…Εΰ―θΜ·ΧΦΘ§Εΰ―θΜ·ΧΦ Ι ·Μ“Υ°ΉÉ€Üùα���ΓΘΕχΝμ“ΜΦ·öβΤΩ÷–ΒΡ ·Μ“Υ°¦]ΉÉΜ·���Θ§³t‘≠¹μΒΡöβσw“ΜΕ®ûιöδöβ�Θ§“ρûιöδöβ»Φüΐ÷ΜΡή…ζ≥…Υ°ΓΘ
29.Ϋώ”–Υ°���ΓΔϊ}Υα��ΓΔöδ―θΜ·βc»ΐΤΩüo…Ϊ“Κσw����Θ§‘艔ηb³eΥϋ²É?
»Γ»ΐ÷ß‘΅Ιή����Θ§≤ΔΖ÷³eΒΙ»κΈ¥÷Σ“Κ1mL÷Ν2mLΘ§»ΜΚσΗςΒΈ»κ ·»ο‘΅“Κ2ΒΈ÷Ν3ΒΈ���Θ§’ώ é����Θ§”^≤λ§F(xi®Λn)œσΓΘ Ι ·»ο‘΅“ΚΉÉΦt’Ώ�Θ§‘≠“Κσwûιϊ}ΥαΓΘ Ι ·»ο‘΅“ΚΉÉΥ{(l®Δn)’Ώ���Θ§‘≠“Κσwûιöδ―θΜ·βc��ΓΘ ·»ο‘΅“Κ≤ΜΉÉ…Ϊ»‘ûιΉœ…Ϊ’Ώ��Θ§‘≠“ΚσwûιΥ°����ΓΘ
30.”Ο“ΜΖN‘΅³©���Θ§»γΚΈ¨ΔΧΦΥαβ¦�ΓΔœθΥαψy����ΓΔΝρΥαδ\»ΐΖN»ή“ΚÖ^(q®±)³eι_?
»Γ»ΐ÷ß‘΅ΙήΘ§≤ΔΖ÷³eΒΙ»κΈ¥÷Σ“Κ1mL÷Ν2mL���Θ§»ΜΚσΗςΒΙ»κ1mL÷Ν2mLϊ}Υα�Θ§”^≤λ§F(xi®Λn)œσΓΘ»τ“Μ²Ä‘΅Ιή÷–”–üo…Ϊöβ≈ίΖ≈≥ω’Ώ���Θ§‘≠»ή“ΚûιΧΦΥα⦻ޓΚ���ΓΘ
K2CO3+2HCl=2KCl+H2O+CO2↑
»τ“Μ²Ä‘΅Ιή÷–”–ΑΉ…Ϊ≥ΝΒμ…ζ≥…’ΏΘ§‘≠»ή“ΚûιœθΥαψy»ή“Κ��ΓΘ
AgNO3+HCl=AgCl↓+HNO3
»γ“Μ²Ä‘΅Ιή÷–Φ»üoöβ≈ίΖ≈≥ω“≤üoΑΉ…Ϊ≥ΝΒμ…ζ≥…�Θ§”÷üoΤδΥϋ§F(xi®Λn)œσΑl(f®Γ)…ζΒΡΘ§‘≠»ή“ΚûιΝρΥαδ\»ή“Κ����ΓΘ
31.Ϋώ”–¬»Μ·β¦�ΓΔœθΥαβ¦ΓΔΧΦΥαβ¦��ΓΔΝρΥαβ¦ΥΡΖNΑΉ…ΪΙΧσwΖέΡ©�Θ§‘艔ηb³eΥϋ²É?
»Γ¬»Μ·β¦ΓΔœθΥαβ¦��ΓΔΧΦΥαβ¦�ΓΔΝρΥαβ¦ΥΡΖNΑΉ…ΪΙΧσwΖέΡ©Ης“ΜΥé≥Ή����Θ§Ζ÷³eΖ≈»κΥΡ²Äüΐ±≠÷–����ΓΘ‘Ό‘ΎΗςüΐ±≠÷–Φ”ΏmΝΩ’τπsΥ° ΙΤδΆξ»Ϊ»ήΫβΘ§ΒΟΥΡΖNüo…Ϊ»ή“Κ�ΓΘ
»ΓΥΡ÷ß‘΅ΙήΖ÷³eΒΙ»κΈ¥÷Σ“Κ1mL÷Ν2mLΘ§≤ΔΆυΥΡ÷ß‘΅Ιή÷–Φ”»κ1mL÷Ν2mLϊ}Υα���ΓΘΤδ÷–“Μ÷ß‘΅Ιή÷–”–üo…Ϊöβ≈ί°a(ch®Θn)…ζ���Θ§³t‘≠ΈοΌ|(zh®§)ûιΧΦΥαβ¦ΓΘ
K2CO3+2HCl=2KCl+H2O+CO2↑
ΤδΥϋ»ΐ÷ß‘΅Ιή÷–¦]”–öβ≈ί…ζ≥…���Θ§“≤üoΤδΥϋ§F(xi®Λn)œσΑl(f®Γ)…ζ���ΓΘ“ρ¬»Μ·β¦ΓΔœθΥαβ¦���ΓΔΝρΥα⦻ΐΖN»ή“ΚΗζϊ}ΥαΕΦ≤ΜΖ¥ëΣ(y®©ng)���ΓΘ
‘Ό»Γ»ΐ÷ß‘΅ΙήΖ÷³eΒΙ»κ”ύœ¬ΒΡ»ΐΖNΈ¥÷Σ“Κ1mL÷Ν2mL≤ΔΆυ»ΐ÷ß‘΅Ιή÷–Φ”»κ1mL÷Ν2mL¬»Μ·δ^»ή“Κ�Θ§Τδ÷–“Μ²Ä”–ΑΉ…Ϊ≥ΝΒμ…ζ≥…�Θ§‘ΌΒΈ»κ1mL÷Ν2mLœΓœθΥαΓΘ»γΙϊΑΉ…Ϊ≥ΝΒμ≤Μœϊ ß�Θ§³t¥Υ‘≠ΈοΌ|(zh®§)ûιΝρΥαβ¦ΓΘ
K2SO4+BaCl2=BaSO4↓+2KCl
ΤδΥϋÉ…÷ß‘΅Ιή÷–¦]”–ΑΉ…Ϊ≥ΝΒμ…ζ≥…����Θ§“≤üo³eΒΡ§F(xi®Λn)œσΑl(f®Γ)…ζΓΘ“ρû鬻̷β¦����ΓΔœθΥαβ¦É…ΖN»ή“ΚΗ欻̷δ^»ή“ΚΕΦ≤ΜΖ¥ëΣ(y®©ng)ΓΘ
‘Ό»ΓÉ…÷Μ‘΅ΙήΖ÷³eΒΙ»κ”ύœ¬ΒΡÉ…ΖNΈ¥÷Σ“Κ1mL÷Ν2mL�Θ§≤ΔΆυÉ…÷ß‘΅Ιή÷–Φ”»κ1mL÷Ν2mLœθΥαψy»ή“ΚΘ§Τδ÷–“Μ²Ä”–ΑΉ…Ϊ≥ΝΒμ…ζ≥…����Θ§‘ΌΒΈ»κ1mL÷Ν2mLœΓœθΥαΘ§»γΙϊΑΉ…Ϊ≥ΝΒμ≤Μœϊ ß����Θ§³t¥Υ‘≠ΈοΌ|(zh®§)û鬻̷β¦�ΓΘ
KCl+AgNO3=AgCl↓+KNO3
‘ΎΝμ“Μ‘΅Ιή÷–¦]”–ΑΉ…Ϊ≥ΝΒμ…ζ≥…Θ§“≤üoΤδΥϋ§F(xi®Λn)œσΑl(f®Γ)…ζ����ΓΘ“ρûιœθΥα⦻ޓΚΗζœθΥαψy»ή“Κ≤ΜΖ¥ëΣ(y®©ng)����ΓΘ
Υυ“‘�Θ§”ύœ¬ΒΡ“ΜΖN‘≠ΈοΌ|(zh®§)ûιœθΥαβ¦ΓΘ
32.»γΚΈηbΕ®“ΜΤΩüo…Ϊ“Κσwûιϊ}Υα?
ϊ}Υα»ή“Κ÷–ΒΡξ•κxΉ”ûιöδκxΉ”(H+)����Θ§ξéκxΉ”û鬻κxΉ”(Cl-)ΓΘ»γΙϊΆ®Ώ^“ΜΕ®ΒΡ¨çρû≤ΫσEΚΆΨΏσwΒΡ¨çρû§F(xi®Λn)œσΡή¥_Ε®»ή“Κ÷–Φ»Κ§”–öδκxΉ””÷Κ§”–¬»κxΉ”����Θ§ΨΆΡή¥_Ε®‘™üo…Ϊ»ή“Κ“ΜΕ®ûιϊ}ΥαΓΘ
ôzρûöδκxΉ”(H+)��ΓΘΑ―É…âKδ\ΝΘΖ≈»κ“Μ÷ß‘΅Ιή÷–�Θ§¨Δ…ΌΝΩ¥ΐηbΕ®ΒΡüo…Ϊ»ή“ΚΒΙ»κ‘΅Ιή÷–3mL—5mLΘ§”ΟΡ¥÷ΗΕ¬ΉΓ‘΅ΙήΩΎ�Θ§¥ΐ‘΅Ιή÷–öβσw¨ΠΡ¥÷ΗΒΡâΚΝΠί^¥σïrΘ§“Τι_Ρ¥÷Η��Θ§ΝΔΦ¥”Ο»Φ÷χΒΡΜπ≤ώϋc»Φ‘΅Ιή÷–ΒΡöβσw��Θ§»γΙϊöβσwΑ≤λo»ΦüΐΜρΑl(f®Γ)≥ωΦβδJΒΡ±§χQ¬ïΘ§ΉCΟς”–öδöβ…ζ≥…���Θ§“≤ΨΆΉCΟς‘≠üo…Ϊ»ή“Κ÷–Κ§”–öδκxΉ”(H+)���ΓΘ
Μρ”ΟΗ…‘ο«εùçΒΡ≤ΘΝßΑτ’Κ»Γ¥ΐ€yüo…Ϊ»ή“ΚΒΈ‘ΎΥ{(l®Δn)…ΪΒΡ ·»ο‘΅Φà…œΘ§»τΥ{(l®Δn)…Ϊ ·»ο‘΅ΦàΉÉΦt�Θ§³tΉCΟς»ή“Κ÷–öδκxΉ”(H+)ΒΡ¥φ‘ΎΓΘ
ôzρû¬»κxΉ”(Cl-)��ΓΘ»Γ“Μ÷ß‘΅Ιή���Θ§ΒΙ»κ¥ΐ€y»ή“Κ1mL÷Ν2mL»ΜΚσΦ”»κ1mL÷Ν2mLœθΥαψy»ή“Κ��Θ§’ώ é�Θ§”^≤λ§F(xi®Λn)œσ����ΓΘ»γΙϊ”–ΑΉ…Ϊ≥ΝΒμ…ζ≥…Θ§‘ΌΦ”»κ1mL÷Ν2mLœΓœθΥα���Θ§»τ≥ΝΒμ≤Μœϊ ß��Θ§³tΉCΟς¬»κxΉ”(Cl-)ΒΡ¥φ‘ΎΓΘ
‘™üo…Ϊ»ή“Κ÷–Φ»Κ§”–öδκxΉ””÷Κ§”–¬»κxΉ”Θ§³t¥Υ»ή“Κûιϊ}Υα�ΓΘ
33.»γΚΈôzρûH+ΓΔAg+���ΓΔOH-�ΓΔCl-���ΓΔSO42-�ΓΔCO32-ΝυΖNκxΉ”?
(1)H+ôzρû����ΓΘ
ΖΫΖ®1¨ΔΉœ…Ϊ ·»ο‘΅“ΚΒΈ»κ Δ”–…ΌΝΩ¥ΐ€y“ΚΒΡ‘΅Ιή÷–Θ§’ώ é��Θ§»γΙϊ ·»ο‘΅“ΚΉÉΦt����Θ§³tΉCΟςH+¥φ‘ΎΓΘ
ΖΫΖ®2”ΟΗ…‘ο«εùçΒΡ≤ΘΝßΑτ’Κ»ΓΈ¥÷Σ“ΚΒΈ‘ΎΥ{(l®Δn)…Ϊ ·»ο‘΅Φà…œ���Θ§»γΙϊΥ{(l®Δn)…Ϊ‘΅ΦàΉÉΦt��Θ§³tΉCΟςH+ΒΡ¥φ‘Ύ����ΓΘ
ΖΫΖ®3”ΟΗ…‘ο«εùçΒΡ≤ΘΝßΑτ’Κ»ΓΈ¥÷Σ“ΚΒΈ‘ΎpH‘΅Φà…œΘ§»ΜΚσΑ―‘΅Φàο@ ΨΒΡν¹…ΪΗζ‰Υ(bi®Γo)€ (zh®≥n)±»…ΪΩ®¨Π’’�Θ§±ψΩ…÷ΣΒά»ή“ΚΒΡpHΘ§»γΙϊpH–Γ”Ύ7�Θ§³tΉCΟςH+ΒΡ¥φ‘ΎΓΘ
(2)Ag+ôzρû���ΓΘ
¨Δ…ΌΝΩϊ}ΥαΜρ…ΌΝΩΩ…»ή–‘ΒΡϊ}Υαϊ}»ή“ΚΒΙ»κ Δ”–…ΌΝΩ¥ΐ€y“ΚΒΡ‘΅Ιή÷–���Θ§’ώ éΘ§»γΙϊ”–ΑΉ…Ϊ≥ΝΒμ…ζ≥…���Θ§‘ΌΦ”»κ…ΌΝΩΒΡœΓœθΥα��Θ§»γΙϊ≥ΝΒμ≤Μœϊ ß����Θ§³tΉCΟςAg+ΒΡ¥φ‘Ύ����ΓΘ
(3)OH-ΒΡôzρûΓΘ
ΖΫΖ®1¨ΔΉœ…Ϊ ·»ο‘΅“ΚΒΈ»κ Δ”–…ΌΝΩ¥ΐ€y“ΚΒΡ‘΅Ιή÷–���Θ§’ώ é����Θ§»γΙϊ ·»ο‘΅“ΚΉÉΥ{(l®Δn)����Θ§³tΉCΟςOH-ΒΡ¥φ‘ΎΓΘ
ΖΫΖ®2”ΟΗ…‘ο«εùçΒΡ≤ΘΝßΑτ’Κ»ΓΈ¥÷Σ“ΚΒΈ‘ΎΦt…Ϊ ·»ο‘΅Φà…œ����Θ§»γΙϊΦt…Ϊ ·»ο‘΅ΦàΉÉΥ{(l®Δn)Θ§³tΉCΟςOH-ΒΡ¥φ‘Ύ��ΓΘ
ΖΫΖ®3¨Δüo…ΪΒΡΖ”ΧΣ‘΅“ΚΒΈ»κ Δ”–…ΌΝΩ¥ΐ€y“ΚΒΡ‘΅Ιή÷–��Θ§’ώ é�Θ§»γΙϊΖ”ΧΣ‘΅“ΚΉÉΦtΘ§³tΉCΟςOH-ΒΡ¥φ‘Ύ����ΓΘ
ΖΫΖ®4”ΟΗ…‘ο«εùçΒΡ≤ΘΝßΑτ’Κ»ΓΈ¥÷Σ“ΚΒΈ‘ΎpH‘΅Φà…œΘ§»ΜΚσΑ―‘΅Φàο@ ΨΒΡν¹…ΪΗζ‰Υ(bi®Γo)€ (zh®≥n)±»…ΪΩ®¨Π’’�Θ§±ψΩ…÷ΣΒά»ή“ΚΒΡpHΘ§»γΙϊpH¥σ”Ύ7���Θ§³tΉCΟςOH-ΒΡ¥φ‘Ύ�ΓΘ
(4)Cl-ΒΡôzρûΓΘ
¨Δ…ΌΝΩΒΡœθΥαψy»ή“ΚΒΙ»κ Δ”–…ΌΝΩ¥ΐ€y“ΚΒΡ‘΅Ιή÷–���Θ§’ώ é���Θ§»γΙϊ”–ΑΉ…Ϊ≥ΝΒμ…ζ≥…Θ§‘ΌΦ”»κ…ΌΝΩΒΡœΓœθΥα���Θ§»γΙϊ≥ΝΒμ≤Μœϊ ß�Θ§³tΉCΟςCl-ΒΡ¥φ‘Ύ�ΓΘ
(5)SO42-ΒΡôzρûΓΘ
¨Δ…ΌΝΩ¬»Μ·δ^»ή“ΚΜρœθΥαδ^»ή“ΚΒΙ»κ Δ”–…ΌΝΩ¥ΐ€y“ΚΒΡ‘΅Ιή÷–��Θ§’ώ é���Θ§»γΙϊ”–ΑΉ…Ϊ≥ΝΒμ…ζ≥…��Θ§‘ΌΦ”»κ…ΌΝΩΒΡœΓœθΥα��Θ§»γΙϊ≥ΝΒμ≤Μœϊ ß�Θ§³tΉCΟςSO42-ΒΡ¥φ‘Ύ����ΓΘ
(6)CO32-ΒΡôzρû����ΓΘ
¨Δ…ΌΝΩΒΡϊ}ΥαΜρœθΥαΒΙ»κ Δ”–…ΌΝΩ¥ΐ€y“ΚΒΡ‘΅Ιή÷–��Θ§»γΙϊ”–üo…ΪöβσwΖ≈≥ω�Θ§¨Δ¥ΥöβσwΆ®»κ Δ”–…ΌΝΩ≥Έ«ε ·Μ“Υ°ΒΡ‘΅Ιή÷–����Θ§»γΙϊ ·Μ“Υ°ΉÉ€ÜΘ§³tΉCΟς‘≠¥ΐ€y“Κ÷–CO32-ΒΡ¥φ‘Ύ�ΓΘ
34.“ΜΫM”–ξP(gu®Γn)Ά–±PΧλΤΫΒΡΏx™ών}Έω
Ά–±PΧλΤΫ‘Ύ≥θ÷–Μ·¨W(xu®Π)¨çρû÷–’Φ”–÷Ί“ΣΈΜ÷ΟΘ§“‘¥ΥûιΡΩΒΡ‘O(sh®®)”΄“Μ–©Ώx™ών}¹μΩΦ≤λ¨W(xu®Π)…ζ «ΖώΏ_(d®Δ)ΒΫëΣ(y®©ng)÷Σïΰ”ΟΒΡ‰Υ(bi®Γo)€ (zh®≥n)ΦΑ»γΚΈ”ΟΤΫΚβΒΡ”^ϋc¹μΖ÷ΈωΧλΤΫ…œΒΡΜ·¨W(xu®Π)Ζ¥ëΣ(y®©ng)�Θ§Ώ@¨Π≈ύπB(y®Θng)¨W(xu®Π)…ζΖ÷ΈωÜ•ν}ΚΆΫβ¦QÜ•ν}ΒΡΡήΝΠΘ§ΨΏ”–ΚήΗΏΒΡ¨ç”ΟÉr÷Β����ΓΘ
“ΜΓΔΆ–±PΧλΤΫ Ι”ΟΒΡΜυΒA(ch®≥)÷ΣΉR
άΐ1ΘΚ‘Ύ Ι”ΟΆ–±PΧλΤΫ«Α��Θ§÷Ηα‰ΤΪœρ”“ΏÖ���Θ§“Σ ΙΧλΤΫ÷Ηα‰÷Η‘ΎΝψϋc����ΓΔΡ«Ο¥ëΣ(y®©ng)¨Δ(ΓΓΓΓ )
A.ΉσΕΥΒΡ¬ίΫzœρΆβ’{(di®Λo)Ιù(ji®Π)
B.”“ΕΥΒΡ¬ίΫzœρΆβ’{(di®Λo)Ιù(ji®Π)
C.ΉσΕΥΒΡ¬ίΫzœράο’{(di®Λo)Ιù(ji®Π)
D.”“ΕΥΒΡ¬ίΫzœράο’{(di®Λo)Ιù(ji®Π)
Ζ÷ΈωΘΚΆ–±PΧλΤΫ «Ηυ™ΰ(j®¥)Ηή½U‘≠άμ÷Τ≥…ΒΡΘ§÷Ηα‰ΤΪœρ”“ΏÖ����Θ§’fΟς”“±PΒΡΌ|(zh®§)ΝΩΗΏΓΘ“ρ¥Υ���Θ§’{(di®Λo)Ιù(ji®Π)¬ίΫzΒΡΖΫΖ®”–É…ΖNΘΚΔΌΙΧΕ®ΉσΕΥ¬ίΫz���Θ§Α―”“ΕΥΒΡ¬ίΫzœράο’{(di®Λo)ΓΘΔΎΙΧΕ®”“ΕΥ¬ίΫz�Θ§¨ΔΉσΕΥΒΡ¬ίΫzœρΆβ’{(di®Λo)Ιù(ji®Π)ΓΘο@»Μ��Θ§¥Υν}ëΣ(y®©ng)Ώx™ώA���ΓΔD�ΓΘ
Εΰ���ΓΔΈο����ΓΔ¥aΈΜ÷ΟνçΒΙ¨Π¨çρûîΒ(sh®¥)™ΰ(j®¥)ΒΡ”Αμë
άΐ2ΘΚ”ΟΆ–±PΧλΤΫΖQΝΩïrΘ§”–Ά§¨W(xu®Π)¨Δμά¥a≈cΖQΝΩΈοΒΡΈΜ÷ΟνçΒΙΝΥ����Θ§Ήσ±PΥυΦ”μά¥aûι6gΘ§”Έ¥a“ΤΒΫΩΧΕ»≥Ώ…œ0.4gΧéΏ_(d®Δ)ΒΫΤΫΚβ�Θ§³tΖQΝΩΈοΒΡ¨çκHΌ|(zh®§)ΝΩ «ΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓ(ΓΓΓΓ )
A.6.4g;ΓΓ B.6g;ΓΓ C.5.6g;ΓΓ D.5.4g
ΈωΫβΘΚΆ–±PΧλΤΫΤΫΚβ±ΊμöùMΉψœ¬Ν–ξP(gu®Γn)œΒΘΚΉσ±P±ΜΖQΈοΌ|(zh®§)Ό|(zh®§)ΝΩ=”“±Pμά¥aΌ|(zh®§)ΝΩ+”Έ¥aΌ|(zh®§)ΝΩΓΘ°î(d®Γng)μά¥aΚΆΖQΝΩΈοΈΜ÷ΟνçΒΙïr����Θ§³t”–mΖQΝΩΈο+0.4=6Θ§ο@»Μ¥πΑΗûιC��ΓΘ
»ΐ����ΓΔΧλΤΫ…œΜ·¨W(xu®Π)Ζ¥ëΣ(y®©ng)¨ΠΤδΤΫΚβΒΡ”Αμë
άΐ3ΘΚ”–“ΜΆ–±PΧλΤΫ�Θ§Ήσ”“É…±PΒΡüΐ±≠÷–Ψυ³ρ Δ”–Ό|(zh®§)ΝΩΓΔùβΕ»œύΆ§ΒΡΉψΝΩœΓΝρΥαΧλΤΫΤΫΚβ�Θ§ΆυΉσ”“É…²Äüΐ±≠÷–Ζ÷³eΦ”»κ1gFeΖέΚΆZnΖέΘ§÷Ηα‰ΉνΫKΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓ (ΓΓΓΓ )
A.ΤΪΉσΓΓΓΓΓΓB.ΤΪ”“
C.≤ΜΤΪόD(zhu®Θn)ΓΓ D.üoΖ®≈–îύ
Ζ÷ΈωΘΚηFΚΆδ\ΗζΉψΝΩœΓΝρΥαΖ¥ëΣ(y®©ng)���Θ§Ψυ…ζ≥…+2ÉrΒΡκxΉ”���Θ§”…”ΎηFΒΡœύ¨Π‘≠Ή”Ό|(zh®§)ΝΩ±»δ\–Γ��Θ§‘ΎΌ|(zh®§)ΝΩœύΆ§ΒΡ«ι¦rœ¬���Θ§÷Ο™Q≥ω»ΞΒΡöδöβΕύΘ§“ρΕχΉσΏÖüΐ±≠÷–ΒΡ»ή“ΚΌ|(zh®§)ΝΩί^–Γ����Θ§÷Ηα‰œρ”“ΤΪΓΘ¥πΑΗûιB���ΓΘ
άΐ4ΘΚ‘ΎA��ΓΔBÉ…üΐ±≠÷–�Θ§Ζ÷³e Δ”–Β»Ό|(zh®§)ΝΩΒ»ùβΕ»ΒΡΉψΝΩΝρΥα���Θ§Α―A����ΓΔBÉ…üΐ±≠Ζ≈‘ΎΧλΤΫΉσ”“É…±P÷–��Θ§ΧλΤΫΤΫΚβ��ΓΘ»τ‘ΎAüΐ±≠÷–Φ”»κ4.4gCuOΘ§Ρ«Ο¥‘ΎBüΐ±≠÷–Φ”»κΕύ…ΌΩΥφV½l���Θ§ΧλΤΫ‘Ό¥ΈΏ_(d®Δ)ΒΫΤΫΚβ
(ΓΓΓΓ )
A.4.4gΓΓ B.4.8gΓΓ C.8.8gΓΓ D.9.6g
ΈωΫβΘΚAüΐ±≠÷–Φ”»κΒΡ4.4gCuO≈cΝρΥαΖ¥ëΣ(y®©ng)Κσ�Θ§üoöβσwΖ≈≥ω���Θ§Éτ‘ωΌ|(zh®§)ΝΩ4.4g�ΓΔ‘ΎBüΐ±≠÷–Φ”»κΒΡMg≈cΝρΥαΖ¥ëΣ(y®©ng)Ζ≈≥ωH2���Θ§÷Μ”–Büΐ±≠÷–Φ”»κMgΒΡΌ|(zh®§)ΝΩ≈cΖ≈≥ωH2Ό|(zh®§)ΝΩ÷°≤νΒ»”Ύ4.4g���Θ§ΧλΤΫ≤≈ΡήΏ_(d®Δ)ΒΫΤΫΚβΓΘ
‘O(sh®®)Büΐ±≠÷–Φ”»κMgxΩΥ
Mg+H2SO4=MgSO4+H2↑ΓΓ m
24 2ΓΓ 22
xgΓΓ 4.4g
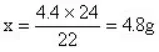
¥πΑΗëΣ(y®©ng)ûιB
35.Μ·¨W(xu®Π)¨çρû”Ο’Z±φΈω
1.“»ήΜ·”≈c“»έΜ·”
“»ήΜ·” «÷ΗΙΧσw‘ΎΥ°(ΜρΤδΥϋ“Κσw)÷–»ήΫβΓΘ»γ’αΧ«‘ΎΥ°÷–»ήΜ·ΝΥ����Θ§Ββ‘ΎΨΤΨΪ÷–»ήΜ·ΝΥ���ΓΘ
“»έΜ·” «÷ΗΙΧσwΦ”üαΒΫ“ΜΕ®≥ΧΕ»ΉÉ≥…ΝΥ“ΚëB(t®Λi)ΓΘ»γηFΦ”üαΒΫ1535Γφïr»έΜ·≥…ηFΥ°Θ§ΝρΦ”üαΒΫ112.8ΓφïrΦ¥ΉÉ≥…“ΚëB(t®Λi)Νρ����ΓΘ
2.“’τΑl(f®Γ)”≈c“’τπs”
“’τΑl(f®Γ)” «‘ΎΦ”üα½lΦΰœ¬»ή“Κάο»ή³©öβΜ·ΒΡΏ^≥Χ����ΓΘΥϋΡή Ι»ή“ΚùβΩsΜρ»ήΌ|(zh®§)“‘ΨßσwΈω≥ω��ΓΘ’τΑl(f®Γ)“ΜΑψ‘Ύ’τΑl(f®Γ)Οσ÷–ΏM(j®§n)––ΓȻ㬻̷βc»ή“ΚΫ¦(j®©ng)’τΑl(f®Γ)ΚσΩ…ΒΟNaClΨßσw���ΓΘ
“’τπs” «άϊ”Ο“ΚσwΜλΚœΈοΗςΫMΖ÷ΒΡΖ–ϋc≤ΜΆ§��Θ§ Ι“ΚσwöβΜ·ΕχΏM(j®§n)––ΒΡΖ÷κx≤ΌΉς���Θ§Υϋ «Ζ÷κxΜρΧαΦÉ“ΚëB(t®Λi)ΜλΚœΈοΒΡ≥Θ”ΟΖΫΖ®���ΓΘ’τπs“ΜΑψ‘Ύ’τπsüΐΤΩ÷–ΏM(j®§n)––����ΓΘ»γ’τπsΥ°ΨΆ «”Ο’τπsΖΫΖ®÷Τ»ΓΒΡ����ΓΘ
3.“Ά®»κ”≈c“≤ε»κ”
“Ά®»κ”“ΜΑψ÷ΗΡ≥öβσwΆ®Ώ^¨ß(d®Θo)ΙήΏM(j®§n)»κΡ≥ΖN»ή“Κάο���ΓΘάΐ»γΑ―CO2öβσwΆ®»κΒΫ ·Μ“Υ°÷–�ΓΘ
“≤ε»κ”“ΜΑψ÷ΗΡ≥ΖN≤ΘΝßÉxΤςΖ≈ΏM(j®§n)Νμ“ΜΖNÉxΤς÷–ΜρΡ≥“ΚσwÉ»(n®®i)���ΓΘ»γΑ―≤ΘΝßΙή≤ε»κœπΤΛ»ϊ÷–Θ§”÷»γ‘Ύ÷ΤCO2¨çρû÷–�Θ§ûιΝΥΖά÷ΙöβσwèΡιLνi¬©ΕΖ“ί≥ω�Θ§–η¨Δ¬©ΕΖœ¬ΕΥ≤ε»κ“ΚΟφ“‘œ¬ΓΘ
4.“ηb³e”≈c“ηbΕ®”
“ηb³e” «Ηυ™ΰ(j®¥)ΈοΌ|(zh®§)ΒΡΧΊ’ς¨ΔéΉΖNΈοΌ|(zh®§)Ö^(q®±)Ζ÷��ΓΔ±φ³e≥ω¹μΓΘ»γηb³eNaClΚΆNa2SO4»ή“Κ�Θ§Ω…”ΟΒΈ»κBaCl2»ή“ΚΒΡΖΫΖ®Θ§°a(ch®Θn)…ζΑΉ…Ϊ≥ΝΒμΒΡ‘≠»ή“ΚûιNa2SO4»ή“Κ���Θ§üoΉÉΜ·ΒΡ‘≠»ή“ΚûιNaCl»ή“Κ���ΓΘ
“ηbΕ®” «“Σ¥_Ε®Ρ≥ΈοΌ|(zh®§)ΒΡΫM≥…Μρ «Ζώ¥φ‘ΎΓΘάΐ»γ���Θ§ηbΕ®Ρ≥ΑΉ…ΪΨßσw «ΖώNH4ClΘ§ΨΆ–ηΉCΟς‘™ΑΉ…ΪΨßσw÷–Φ»Κ§”–NH4+����Θ§”÷Κ§”–Cl-��ΓΘ
”÷»γ�Θ§”ΟΒΈΦ”ϊ}ΥαΒΡΖΫΖ®Ω…ηbΕ®…ζ ·Μ“÷– «ΖώΚ§”– ·Μ“ ·ΓΘ
Ψ≈����ΓΔ≥Θ“ä¨çρûÉxΤςΒΡ”ΟΆΨ”ΟΖ®
36.‘΅Ιή
÷ς“Σ”ΟΆΨ
ΔΌ”ΟΉς…ΌΝΩ‘΅³©ΒΡΖ¥ëΣ(y®©ng)»ίΤς
ΔΎ―b÷Ο–Γ–ΆöβσwΑl(f®Γ)…ζΤς
Δέ ’Φ·…ΌΝΩöβσw
Ι”ΟïrΉΔ“β ¬μ½
ΔΌΩ…“‘Φ”üα,Φ”üαïr“Σ Ι”Ο‘΅ΙήäA,äA≥÷‘΅ΙήΒΡ÷–…œ≤Ω
ΔΎΦ”üα“Κσw,“Κσw≤ΜΒΟ≥§Ώ^‘΅Ιή»ίΖeΒΡ1/3
ΔέΦ”üαΚσ≤ΜΡήσEάδ
37.Ά–±PΧλΤΫ
Ά–±PΧλΤΫ «¨çρû “άο”Ο”ΎΖQΝΩΈοΌ|(zh®§)Ό|(zh®§)ΝΩΒΡÉxΤς���ΓΘΟΩ“Μ≈_ΧλΤΫΕΦ”–≈cΤδœύ≈δΧΉΒΡμά¥aΚ–Θ§μά¥aΌ|(zh®§)ΝΩΉν–ΓΒΡûι1g�Θ§–Γ”Ύ1gΌ|(zh®§)ΝΩΒΡ «Τ§¥a���Θ§”–100mgΓΔ200mg�ΓΔ500mgΒ»ΕύΖN����ΓΘ“≤”–ΒΡΆ–±PΧλΤΫ÷Μ”–5g“‘…œΒΡμά¥aΘ§ΖQΝΩ5g“‘œ¬Ό|(zh®§)ΝΩïr�Θ§ «”Ο“Τ³””Έ¥aΒΡόkΖ®��ΓΘ Ι”ΟΆ–±PΧλΤΫΖQΝΩΈοΌ|(zh®§)«ΑΘ§”–”Έ¥aΒΡΆ–±PΧλΤΫëΣ(y®©ng)œ»Α―”Έ¥aΖ≈‘ΎΩΧΕ»≥ΏΒΡΝψΧé���Θ§»ΜΚσôz≤ιΧλΤΫΒΡî[³” «ΖώΏ_(d®Δ)ΒΫΤΫΚβΓΘ»γΙϊΧλΤΫΏ_(d®Δ)ΒΫΤΫΚβ�Θ§λo÷Ιïr÷Ηα‰÷Η‘ΎΩΧΕ»≥ΏΒΡ÷–ιg(ΝψΧé)���Θ§î[³”ïr‘ΎΩΧΕ»≥ΏΉσ”“É…ΏÖî[³”ΒΡΗώîΒ(sh®¥)Ϋ”ΫϋœύΒ»�ΓΘ»γΙϊΧλΤΫΈ¥Ώ_(d®Δ)ΤΫΚβ��Θ§Ω…“‘’{(di®Λo)Ιù(ji®Π)Ήσ”“Ά–±Pœ¬ΒΡ¬ίΡΗ�Θ§ Ιî[³”ïrΏ_(d®Δ)ΤΫΚβ��ΓΘΖQΝΩïrΘ§±ΜΖQΈοΤΖΖ≈‘ΎΉσ±P…œ���Θ§μά¥aΖ≈‘Ύ”“±P��Θ§œ»Φ”Ό|(zh®§)ΝΩ¥σΒΡμά¥a���Θ§ΚσΦ”Ό|(zh®§)ΝΩ–ΓΒΡμά¥aΘ§ΉνΚσΦ”Τ§¥a(“Τ³””Έ¥a)���ΓΘ»Γ”Ομά¥aëΣ(y®©ng) Ι”Οη΅Ή”ΓΘ»τΖQΝΩ÷ΗΕ®Ό|(zh®§)ΝΩΒΡΈοΌ|(zh®§)ïr�Θ§ëΣ(y®©ng)œ»¨Δ‘™Ό|(zh®§)ΝΩΒΡμά¥aΚΆΤ§¥a(Μρ”Έ¥a)Ζ≈‘Ύ”“±P…œ���Θ§»ΜΚσΆυΉσ±P…œΦ”±ΜΖQΈοΌ|(zh®§)Θ§°î(d®Γng)±ΜΖQΈοΌ|(zh®§)ΒΡΌ|(zh®§)ΝΩΫ”ΫϋΥυ–ηΌ|(zh®§)ΝΩïr����Θ§Ω…Ήσ ÷ΡΟΥé≥Ή�Θ§”“ ÷όD(zhu®Θn)≈ΡΉσ ÷��Θ§”Ο’ώ³”Υé≥ΉΒΡΖΫΖ® Ι…ΌΝΩΈοΌ|(zh®§)…Δ¬δœ¬¹μ÷ΝΧλΤΫΤΫΚβ����ΓΘûιΖά÷ΙΜ·¨W(xu®Π)ΥéΤΖ¨ΠΆ–±PΒΡΗ·ΈgΚΆΈέ»ΨΘ§ΥéΤΖ≤ΜΡή÷±Ϋ”Ζ≈‘ΎΆ–±P…œΖQΝΩ����Θ§Ω…Ζ≈»κüΐ±≠���ΓΔ’τΑl(f®Γ)ΟσΚΆ±μΟφΟσΒ»»ίΤς÷–����ΓΘ“≤Ω… Ι”ΟΦàΤ§��Θ§ΖQΝΩ«Α‘ΎÉ…²ÄΆ–±P…œΗςΖ≈“ΜèàΌ|(zh®§)ΝΩœύΫϋΒΡùçÉτΦàΤ§ΓΘΖQΝΩΚσ“ΣΦΑïr”¦δ¦±ΜΖQΈοΒΡΌ|(zh®§)ΝΩ�ΓΘΖQΝΩΆξ°Ö����Θ§ëΣ(y®©ng)Α―μά¥aΚΆη΅Ή”Ζ≈ΜΊμά¥aΚ–�Θ§Α―”Έμά“ΤΜΊΝψΧé��ΓΘ
38.ΨΤΨΪüτ
÷ς“Σ”ΟΆΨ
¨çρû “≥Θ”ΟΒΡΦ”üαÉxΤς
Ι”ΟïrΉΔ“β ¬μ½
ΔΌΨΤΨΪ≤ΜΡή≥§Ώ^ΨΤΨΪüτ»ίΖeΒΡ2/3
ΔΎΫϊ÷Ιœρ»Φ÷χΒΡΨΤΨΪüτΧμΦ”ΨΤΨΪ
ΔέΫϊ÷Ι”Ο»Φ÷χΒΡΨΤΨΪüτ“ΐ»ΦΝμ“Μ÷ΜΨΤΨΪüτ
Δή”Ο°Ö,ëΣ(y®©ng)”ΟüτΟ±…w€γ
ΔίëΣ(y®©ng)”ΟΆβ―φ≤ΩΖ÷ΏM(j®§n)––Φ”üα
39.ιLνi¬©ΕΖ
÷ς“Σ”ΟΆΨ
”Ο”Ύ―b≈δΖ¥ëΣ(y®©ng)ΤςΘ§±ψ”ΎΉΔ»κ“Κσw��Θ§”–Ζά÷Ιöβσw“ί≥ωΒΡΙΠΡήΓΘ

Ι”ΟïrΉΔ“β ¬μ½
ιLνi¬©ΕΖ‘ΎΫM―böβσwΑl(f®Γ)…ζ―b÷Οïr���Θ§ëΣ(y®©ng) ΙιLΙήΡ©ΕΥ≤ε»κΖ¥ëΣ(y®©ng)ΤςÉ»(n®®i)ΒΡ“Κσwάο�Θ§Ζά÷ΙöβσwΆ®Ώ^¬©ΕΖ“ί≥ω��ΓΘ
40.≤ΘΝßΑτ
÷ς“Σ”ΟΆΨ
1.î΅Αη»ή“ΚéΆ÷ζΙΧσwΈοΌ|(zh®§)ΒΡ»ήΫβ
2.Ώ^ûVïr“ΐΝς“Κσw
3.’τΑl(f®Γ)ïrî΅Αη“ΚσwΖά÷ΙΨ÷≤ΩΏ^üαΕχοwûR
4.’Κ»Γ…ΌΝΩ“Κσw

Ι”ΟïrΉΔ“β ¬μ½
1.î΅Αηïr≤ΜΩ…”ΟΝΠΏ^ΟΆ��Θ§Έπ≈ω™τΤς±Ύ�Θ§“‘Ζά÷ΙΤΤΝ―��ΓΘ
2.ΉΔ“βκSïrœ¥€λΘ§“‘ΖάΈέ»Ψ����ΓΘ
3.≤ΜΩ…¨ΔΫΰ“ΚΒΡΑτΕΥΖ≈‘ΎΉάΟφ…œ��ΓΘ
°��ΓΔΜυ±Ψ¨çρû≤ΌΉς
41.”ΟΝΩΆ≤ΝΩ»Γ“Κσw‘΅³©
Ι”ΟΝΩΆ≤ΝΩ“Κïr����Θ§ëΣ(y®©ng)Α―ΝΩΆ≤Ζ≈‘ΎΥ°ΤΫΒΡΉάΟφ…œ����Θ§ Ι―έΒΡ“ïΨÄΚΆ“ΚσwΑΦ“ΚΟφΒΡΉνΒΆϋc‘ΎΆ§“ΜΥ°ΤΫΟφ…œ�Θ§Ήx»ΓΚΆΑΦΟφœύ«–ΒΡΩΧΕ»Φ¥Ω…ΓΘ≤ΜΩ…”Ο ÷≈eΤπΝΩΆ≤Ω¥ΩΧΕ»���ΓΘΝΩ»Γ÷ΗΕ®σwΖeΒΡ“Κσwïr�Θ§ëΣ(y®©ng)œ»ΒΙ»κΫ”ΫϋΥυ–ησwΖeΒΡ“Κσw����Θ§»ΜΚσΗΡ”ΟΡzν^ΒΈΙήΒΈΦ”ΓΘ Ι”ΟΝΩΆ≤ïrëΣ(y®©ng)ΉΔ“βΘΚ”ΟΝΩΆ≤ΝΩ»Γ“ΚσwσwΖe «“ΜΖN¥÷¬‘ΒΡ”΄ΝΩΖ®��Θ§Υυ“‘‘Ύ Ι”Ο÷–±ΊμöΏx”ΟΚœΏmΒΡ“é(gu®©)ΗώΘ§≤Μ“Σ”Ο¥σΝΩΆ≤”΄ΝΩ–ΓσwΖe�Θ§“≤≤Μ“Σ”Ο–ΓΝΩΆ≤Εύ¥ΈΝΩ»Γ¥σσwΖeΒΡ“Κσw���Θ§Ζώ³tΕΦïΰ“ΐΤπί^¥σΒΡ’`≤ν��ΓΘΝΩΆ≤ «Κώ±Ύ»ίΤςΘ§Ϋ^≤ΜΡή”Ο¹μΦ”üαΜρΝΩ»ΓüαΒΡ“Κσw�Θ§“≤≤ΜΡή‘ΎΤδ÷–»ήΫβΈοΌ|(zh®§)��ΓΔœΓα¨ΚΆΜλΚœ“Κσw��Θ§Ηϋ≤ΜΡή”ΟΉωΖ¥ëΣ(y®©ng)»ίΤς�ΓΘ
42.“Κσw‘΅³©ΒΡΒΈ»Γ
”ΟΡzν^ΒΈΙ޻ÔϓΚσw‘΅³©ïr���Θ§“ΣΉΔ“β’ΐ¥_ΒΡΖΫΖ®�Θ§»γàDΥυ ΨΓΘΈϋ»Γ‘΅“Κïrœ»¨ΔΒΈΙήΧα≥ω“ΚΟφ�Θ§îD≥ωΡzν^÷–ΒΡΩ’öβΘ§‘ΌΑ―ΒΈΙή…λ»κ‘΅“Κ÷–Έϋ»Γ����ΓΘΒΈ»κ‘΅ΙήïrΘ§≤ΜΡήΑ―ΒΈΙή…λ»κ‘΅Ιή÷–���Θ§“‘ΟβΒΈΙή≈ωΒΫ‘΅Ιή±ΎΕχ±ΜΈέ»Ψ�ΓΘΈϋ”–‘΅³©ΒΡΒΈΙή≤ΜΩ…ΒΙ÷Ο�Θ§“‘Οβ‘΅³©Νς»κΒΈν^�ΓΘ
43.ùβΥαΓΔùβâAΒΡ Ι”Ο
“ρûιùβΥα��ΓΔùβâA”–Η·Έg–‘���Θ§Υυ“‘ Ι”Οïr±ΊμöΧΊ³e–Γ–Ρ��Θ§Ζά÷Ι’¥ΒΫΤΛΡw…œΜρûΔ‘Ύ“¬Ζΰ…œ���ΓΘ
ΥαΝςΒΫΉάΟφ��Θ§ëΣ(y®©ng)ΝΔΦ¥œρΥαÉ»(n®®i)Φ”ΏmΝΩΒΡΧΦΥαöδβc»ή“Κ����Θ§÷±÷Ν≤Μ‘ΌΑl(f®Γ)…ζöβ≈ί;âA“ΚΝςΒΫΉάΟφ��Θ§ëΣ(y®©ng)ΝΔΦ¥œρâAÉ»(n®®i)Φ”ΏmΝΩœΓ¥ΉΥα�ΓΘΏM(j®§n)––…œ ωΧéάμΚσ����Θ§œ»”ΟΥ°¦_œ¥ΉάΟφ���Θ§‘Ό”ΟΡ®≤Φ≤ΝΗ…Éτ�ΓΘ
ΤΛΡw…œΨΤ…œùβΝρΥαΘ§≤Μ“Σœ»”ΟΥ°¦_œ¥��Θ§Εχ“Σ―ΗΥΌ”Ο≤Φ‘΅»Ξ����Θ§‘Ό”ΟΥ°¦_œ¥�ΓΘΤδΥϋΥα’¥‘ΎΤΛΡw…œ�Θ§ΝΔΦ¥”Ο¥σΝΩΥ°¦_œ¥����ΓΘ»ΜΚσΕΦ“Σ‘ΌΆΩ…œ3%—5%ΒΡΧΦΥαöδβc»ή“Κ;âA’¥ΒΫΤΛΡw…œ����Θ§“≤“Σ”Οί^ΕύΒΡΥ°¦_œ¥Θ§‘ΌΆΩ…œ≈πΥα»ή“Κ��ΓΘ
44.ΙΧσwΈοΌ|(zh®§)ΒΡ―–ΡΞ
―–ΡΞ «÷ΗΑ―ΝΘ†νΙΧσwΖ≈‘Ύ―–άè÷–―–≥…ΖέΡ©ΒΡ≤ΌΉς����ΓΘ
ûιΝΥΦ”ΥΌΈοΌ|(zh®§)ΒΡ»ήΫβΜρΖ¥ëΣ(y®©ng)Θ§≥Θ”Ο¥…ΒΡΜρ≤ΘΝß―–άèΑ―ΈοΌ|(zh®§)―–Υι�Θ§―–ΡΞïrΘ§œ»Α――–άè���ΓΔ―–ηΤœ¥ÉτΩΪΗ…�Θ§”“ ÷Έ’ΉΓ―–ηΤΘ§œ»Α―¥σâKΙΧσwâΚΥι�Θ§‘ΌΈ’ΉΓ―–ηΤ”ΟΏÖâΚΏÖόD(zhu®Θn)³”―–ΡΞ���ΓΘ≤ΔκSïr”ΟΥé≥ΉΑ―’¥‘ΎηΤΚΆάèÉ»(n®®i)±Ύ…œΒΡΙΧσwΙΈœ¬¹μ―–Υι��ΓΘ―–ΡΞΆξ°ÖΚσ���Θ§”ΟΥé≥Ή¨ΔΙΧσwΖέΡ©»Ϊ≤Ω»Γ≥ωΓΘ
±Μ―–ΡΞΙΧσwΝΩ≤Μ“Σ≥§Ώ^»ίΖeΒΡ1/3���ΓΘ≥±ùώΒΡΙΧσw“ΣΫ¦(j®©ng)Η…‘ο��ΓΔάδÖsΚσ‘Ό―–ΡΞ����ΓΘèä(qi®Δng)―θΜ·³©ΒΡΥéΤΖάΐ»γ¬»Υαβ¦��Θ§÷ΜΡή”Ο―–ηΤίpίpâΚΥι��Θ§≤ΜΡή”ΟΝΠ―–ΡΞΘ§“‘Ζά÷Ι±§’® ¬Ι �ΓΘ―–άè”ΟΆξΚσëΣ(y®©ng)ΦΑïrœ¥ÉτΓΔΝάΗ…���ΓΘ
45.ΙΧσwΈοΌ|(zh®§)ΒΡ»ήΫβ
ΙΧσwΈοΌ|(zh®§)»ήΫβïr���Θ§œ»Α―âK†νΙΧσw”Ο―–άèâΚΥι≤Δ―–Φö(x®§)ΓΘûιΦ”Ωλ»ήΌ|(zh®§)‘Ύ»ή³©άοΒΡ»ήΫβΘ§≥Θ≤…”ΟΦ”üα����ΓΔî΅Αη�ΓΔ’ώ éΒ»ΖΫΖ®ΓΘ
‘΅ΙήάοΥυ ΔΒΡ»ήΌ|(zh®§)ΚΆ»ή³©Ω²ΝΩί^…ΌïrΘ§≤Μ≥§Ώ^‘΅Ιή»ίΖeΒΡ1/3ΓΘΨΆ”Ο’ώ éΒΡΖΫΖ®��ΓΘ”Ο”“ ÷ΒΡΡ¥ΓΔ ≥��ΓΔ÷–»ΐ÷ΗΈ’≥÷‘΅Ιή…œΕΥ��Θ§üoΟϊ÷ΗΚΆ–Γ÷Ηèùœρ’Τ–Ρ����Θ§”ΟΏm°î(d®Γng)¥σ–ΓΒΡΆσΝΠ¹μΜΊΥΠ³”‘΅Ιή����Θ§’ώ éïrΘ§≤ΜΡή…œœ¬’ώ é�Θ§Ηϋ≤ΜΡή”ΟΡ¥÷ΗΕ¬ΉΓ‘΅ΙήΩΎΓΘ
üΐ±≠άο»ήΫβΈοΌ|(zh®§)ïr�Θ§”Ο≤ΘΝßΑτ‘Ύüΐ±≠÷–ά@»Πî΅³”Θ§î΅³”ïr≤Μ“Σ Ι≤ΘΝßΑτΚΆΤς±ΎΉ≤™τ��Θ§“‘Ζά÷Ι»ίΤςΤΤΝ―��ΓΘüΐ±≠ΒΉ≤ΩΒΡΙΧσw≤ΜΡή”Ο≤ΘΝßΑτ™vΥι���Θ§“‘Ζά÷ΙηΤΤΤ≤ΘΝß�ΓΘûιΖά÷Ιî΅Αηïr≤ΘΝßΑτ≈ωΉ≤üΐ±≠�Θ§Ω…‘Ύ≤ΘΝßΑτ“ΜΕΥΧΉ…œ“Μ–ΓΕΈ(1cmΓΪ2cm)œπΤΛΙή�Θ§ Ι≤ΘΝßΑτΒΡμîΕΥ≤Μ¬Ε≥ωΓΘ
üΐΤΩ»ήΫβΈοΌ|(zh®§)ïr���Θ§°î(d®Γng)»ή“Κ≤Μ≥§Ώ^üΐΤΩ»ίΖe1/2ïr��Θ§“≤Ω…”Ο’ώ éΖΫΖ®Φ”ΥΌ»ήΌ|(zh®§)ΒΡ»ήΫβ��ΓΘ
46.ùβΝρΥαΒΡœΓα¨
ùβΝρΥα»ί“Ή»ή”ΎΥ°���Θ§Ά§ïrΖ≈≥ω¥σΝΩüαΘ§ΥϋΒΡΟήΕ»”÷¥σ”ΎΥ°��ΓΘ»τ¨ΔΥ°ΉΔ»κΥα÷–���Θ§Υ°ïΰΗΓ‘ΎΝρΥα…œΟφ��Θ§»ήΫβïrΖ≈≥ωΒΡüαïΰ ΙΥ°Ζ–ρv���Θ§ ΙΝρΥαœρΥΡ÷ήοwûR��Θ§Αl(f®Γ)…ζ ¬Ι ΓΘ“ρ¥ΥœΓα¨ùβΝρΥαïrΘ§“ΜΕ®“ΣΑ―ùβΝρΥα―Ί÷χΤς±Ύ¬ΐ¬ΐΒΊΉΔ»κΥ°άοΘ§≤Δ≤Μîύî΅³”Θ§ Ι°a(ch®Θn)…ζΒΡüαΝΩ―ΗΥΌΒΊîU(ku®Α)…ΔΓΘ
öβσwΒΡ»ήΫβ
Ηυ™ΰ(j®¥)öβσw‘ΎΥ°ΜρΈϋ ’³©άοΒΡ»ήΫβ–‘≤ΜΆ§Θ§Ω…≤…”Ο≤ΜΆ§ΒΡΖΫΖ®¹μΈϋ ’öβσw Ι÷°»ήΫβΓΘ‘ΎΥ°÷–‰O“Ή»ήΫβΒΡöβσw»γΑ±��ΓΔ¬»Μ·öδ����ΓΔδεΜ·öδΒ»ëΣ(y®©ng)≤…”ΟBΖ®��Θ§―b÷ΟΧΊϋc «¨ß(d®Θo)öβΙήΏBΫ”ΝΥ“Μ²ÄΒΙΩέΒΡ¬©ΕΖΘ§¬©ΕΖΏÖΨâΫΰ»κΥ°÷–Φs1mmΓΪ2mm����ΓΘΥϋΒΡÉû(y®≠u)ϋc «Ω…Ζά÷ΙΥ°ΒΙΝς»κöβσwΑl(f®Γ)…ζ―b÷ΟΘ§”÷Ω…‘ω¥σΈϋ ’ΟφΖeΘ§άϊ”Ύöβσw≥δΖ÷»ήΫβ�ΓΘΥϋ”–Ή‘³”’{(di®Λo)Ιù(ji®Π)öβσwΑl(f®Γ)…ζ―b÷ΟÉ»(n®®i)ΆβâΚΝΠΎÖ”ΎΤΫΚβΒΡΉς”Ο�ΓΘΦ¥”–Ή‘ΩΊΒΙΈϋΉς”Ο���ΓΘ»γöβσwΒΡ»ήΫβΕ»≤ΜΧΪ¥σ��Θ§»γ¬»öβ�ΓΔΝρΜ·öδΒ»ëΣ(y®©ng)≤…»ΓAΖ®ΓΘ
47.ΈοΌ|(zh®§)ΒΡΖ÷κx≈cΧαΦÉ
(1)Ζ÷κxΘΚΑ―ΜλΚœΈο÷–ΗςΈοΌ|(zh®§)±Υ¥ΥΖ÷ι_Θ§≤Δ¨ΔΗςΈοΌ|(zh®§)Μ÷èΆ(f®¥)ΒΫ‘≠†νëB(t®Λi)���ΓΘ
(2)ΧαΦÉΘΚΑ―ΜλΚœΈο÷–κsΌ|(zh®§)≥ΐ»ΞΓΘ‘ΎΧαΦÉΏ^≥Χ÷–�Θ§»γΙϊκsΌ|(zh®§)Αl(f®Γ)…ζΝΥΜ·¨W(xu®Π)ΉÉΜ·Θ§≤Μ±ΊΜ÷èΆ(f®¥)≥…‘≠ΈοΌ|(zh®§)���ΓΘ
¨ΠΈοΌ|(zh®§)ΏM(j®§n)––Ζ÷κxΜρΧαΦÉïr���Θ§ëΣ(y®©ng)Ηυ™ΰ(j®¥)ΈοΌ|(zh®§)ΦΑΤδΥυΚ§κsΌ|(zh®§)ΒΡ–‘Ό|(zh®§)Ώx”ΟΏm“ΥΒΡΖΫΖ®����ΓΘ
ΥΡΖNΈοΌ|(zh®§)ΧαΦÉΖ®ΒΡ±»ί^
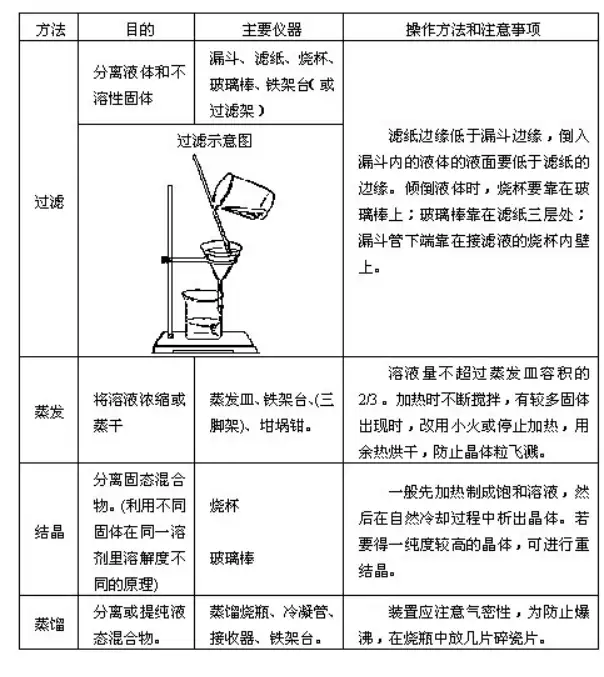
ΈοΌ|(zh®§)ΧαΦÉΖ®ΒΡΏx™ώ
1.Ηυ™ΰ(j®¥)ΈοΌ|(zh®§)–‘Ό|(zh®§)ΒΡ≤ν°ê��Θ§Ώx™ώΚœΏmΒΡΈοάμΖΫΖ®ΏM(j®§n)––ΜλΚœΈοΒΡΖ÷κx(Ώ^ûVΖ®��ΓΔΫY(ji®Π)ΨßΖ®)�ΓΘ≤ΔΡή’ΤΈ’≤ΌΉς≤ΫσEΦΑÉxΤςΒΡ Ι”ΟΘ§÷ΣΒά»ί“Ή≥ωεeΒΡΒΊΖΫ��ΓΘ(“ä±μ(1))
2.Ηυ™ΰ(j®¥)ΈοΌ|(zh®§)ιgΒΡœύΜΞξP(gu®Γn)œΒ���Θ§Ώ\(y®¥n)”ΟΜ·¨W(xu®Π)ΖΫΖ®(Έϋ ’ΓΔόD(zhu®Θn)Μ·) ΙκsΌ|(zh®§)≥ΐ»Ξ��ΓΘ(“ä±μ(2))
ΈοΌ|(zh®§)ΒΡΧαΦɱμ(1)
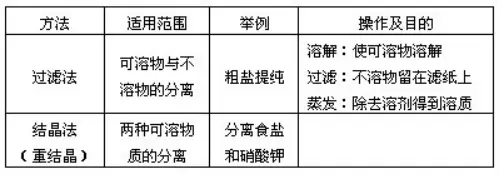
ΈοΌ|(zh®§)ΒΡΧαΦɱμ(2)
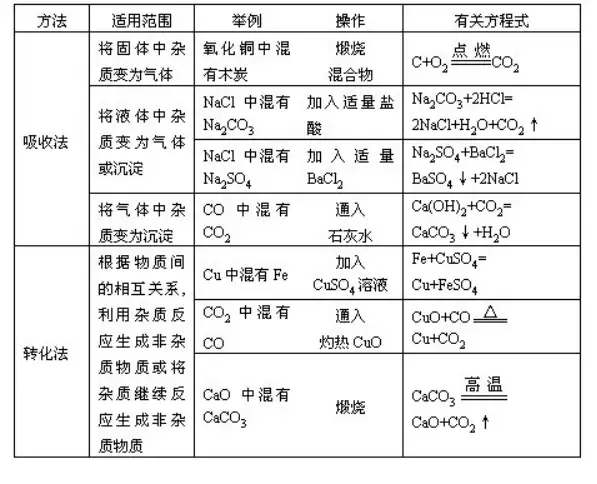
48.öβσwΒΡÉτΜ·
÷ΗΒΡ «öβσwΚΆöβσwΜρΤδΥϋκsΌ|(zh®§)ΒΡΖ÷κxΖΫΖ®��ΓΘ≤…”ΟΒΡΖΫΖ® «¨ΔΜλΚœöβσwΆ®Ώ^―b‘Ύœ¥öβΤΩάοΒΡΡ≥‘΅³©ΒΡ»ή“Κ�Θ§άϊ”ΟΥυ–η“ΣΒΡöβσw≤Μ≈c‘™‘΅³©Ζ¥ëΣ(y®©ng)Θ§“≤≤Μ»ή‘ΎΥ°άο����Θ§ΕχΤδΥϋ≤Μ–η“ΣΒΡöβσwκsΌ|(zh®§)����Θ§ΡήΚΆ‘™‘΅³©Ζ¥ëΣ(y®©ng)…ζ≥…κy™]Αl(f®Γ)ΒΡΈοΌ|(zh®§)���Θ§Ντ‘Ύœ¥öβΤΩάο����Θ§Ώ_(d®Δ)ΒΫΖ÷κxΒΡΡΩΒΡ����ΓΘ
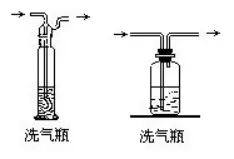
Έϋ ’³©ûι“ΚσwΒΡ―b÷ΟΫ–œ¥öβΤΩΓΘ―b»κΝΩ1/3÷Ν1/2��ΓΘΏx™ώΈϋ ’³©ëΣ(y®©ng)èΡΏ@éΉΖΫΟφΩΦë]ΘΚ“Ή»ή”ΎΥ°ΒΡΈοΌ|(zh®§)”ΟΥ°Έϋ ’;Υα–‘ΈοΌ|(zh®§)”ΟâA–‘ΈοΌ|(zh®§)Έϋ ’;”ΟΩ…≈cκsΌ|(zh®§)…ζ≥…≥ΝΒμΜρΩ…»ήΈοΒΡΈϋ ’³©Έϋ ’;≤ΜΡή÷±Ϋ”Έϋ ’≥ΐ»ΞκsΌ|(zh®§)��Θ§‘O(sh®®)Ζ®Ά®Ώ^“ΜΕ®ΒΡΉÉΜ·����Θ§όD(zhu®Θn)Μ·≥…Ω…Έϋ ’ΒΡΈοΌ|(zh®§)ΓΘ
49.öβσwΒΡΗ…‘ο
≥ΐ»Ξöβσw÷–ΒΡΥ°’τöβΫ–ΉωöβσwΒΡΗ…‘ο�ΓΘ Ι”ΟΈϋ ’³©ûιΙΧëB(t®Λi)ΒΡ―b÷ΟΫ–Η…‘οΙήΓΔΗ…‘οΥΰΒ»���Γ����ΘΩ…”ΟùβΝρΥαΘ§“≤Ω…”ΟüoΥ°¬»Μ·β}ΉςΗ…‘ﳩ»���ΓΘΗ…‘οΙήΒΡ”ΟΖ®���Θ§¥÷ΕΥûιΏM(j®§n)ΩΎΓΔΦö(x®§)ΕΥûι≥ωΩΎ�ΓΘΗ…‘ﳩ≤ΜΡήΧνΒΡΏ^ΨoΘ§ΥϋΒΡνwΝΘ¥σ–Γ“ΣΏm°î(d®Γng)����Θ§≤Μ“ΥΧΪ¥σΘ§“≤≤Μ“ΥΧΪ–Γ�ΓΘΗ…‘ﳩëΣ(y®©ng)‘Ύ Ι”Ο«Α≈RïrΧν≥δΘ§ΜρΖ≈Κφœδ÷–Μρ‘ΎΗ…‘οΤς÷–±Θ¥φ���ΓΘ
Ώx™ώΗ…‘ﳩ“ΣΗυ™ΰ(j®¥)öβσwΒΡ–‘Ό|(zh®§)Θ§Η…‘ﳩ≤ΜëΣ(y®©ng)ΚΆ±ΜΗ…‘οΒΡöβσwΖ¥ëΣ(y®©ng)���ΓΘάΐ»γ�Θ§Η…‘οΑ±öβΨΆ≤ΜΡή”ΟüoΥ°¬»Μ·β}Θ§ëΣ(y®©ng)‘™”ΟâA ·Μ“��ΓΘ“ρΑ±Ρή≈c¬»Μ·β}Ζ¥ëΣ(y®©ng)…ζ≥…CaCl2·8NH3����ΓΘ
Η…‘οΙήΒ»”ΟΏ^ΚσΘ§ëΣ(y®©ng)ΝΔΦ¥Α―Η…‘ﳩ«ε≥ΐ≥ω»Ξ���Θ§≤Δœ¥ΥΔΚσΖ≈÷Ο�ΓΘ
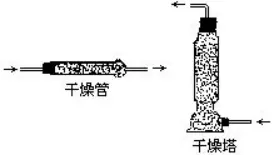
50.¨çρû÷–Α≤»ΪΒΡΉΔ“β ¬μ½
ΔΌ≤ΜΡή”Ο ÷Ϋ””|ΥéΤΖ���Θ§≤Μ“ΣΑ―±«ΩΉ€êΒΫ»ίΤςΩΎ»Ξ¬³ΥéΤΖΒΡöβΈΕ���Θ§≤ΜΒΟ΅LΥéΤΖΒΡΈΕΒάΓΘ
ΔΎΫ^¨ΠΫϊ÷Ιœρ»Φ÷χΒΡΨΤΨΪüτÉ»(n®®i)ΧμΦ”ΨΤΨΪ��ΓΘ
ΔέΫ^¨ΠΫϊ÷Ι”ΟΨΤΨΪüτ“ΐ»ΦΝμ“Μ÷ΜΨΤΨΪüτ��ΓΘ
Δή»f“ΜΨΤΨΪüτÉ»(n®®i)ΒΡΨΤΨΪûΔ‘ΎΉά…œ»ΦüΐΤπ¹μ�Θ§ëΣ(y®©ng)ΝΔΦ¥”Οùώ≤Φ…w€γΓΘ
ΔίùβΥαûΔ‘ΎΉά…œïr��Θ§ëΣ(y®©ng)ΝΔΦ¥”ΟΏmΝΩΒΡΧΦΥαβc»ή“Κ÷–ΚΆ;ùβâA“Κ”ΟœΓ¥ΉΥα÷–ΚΆ���Θ§»ΜΚσ”ΟΥ°¦_œ¥�Θ§”Ο≤Φ≤ΝΗ…ΓΘ»γΙϊùβΝρΥα’¥‘ΎΤΛΡw…œ����Θ§ëΣ(y®©ng)œ»”Ο≤Φ≤Ν»ΞΘ§‘Ό”ΟΥ°œ¥����Θ§»ΜΚσ”Ο3%ΓΪ5%ΒΡΧΦΥαöδβc»ή“Κ÷–ΚΆΓΘ
Δό¨Π”Ύ¨çρû÷–ΒΡ”–ΕΨöβσw��Θ§“Σ≤…»ΓœύëΣ(y®©ng)ΒΡ¥κ ©����Θ§Ά®οL(f®Ξng)≈≈ΕΨΘ§±ΘΉC»ΥσwΒΡΫΓΩΒ����Θ§Ζά÷Ι≠h(hu®Δn)Ψ≥ΒΡΈέ»ΨΓΘ
ΔΏϋc»ΦΩ…»Φ–‘öβσw«Α“ΜΕ®œ»‘΅ρûΥϋΒΡΦÉΕ»�ΓΘ
51.¨çρû “÷Τ²δ―θöβΓΔöδöβΚΆΕΰ―θΜ·ΧΦ Ι”ΟΒΡΥéΤΖΦΑΖ¥ëΣ(y®©ng)‘≠άμ
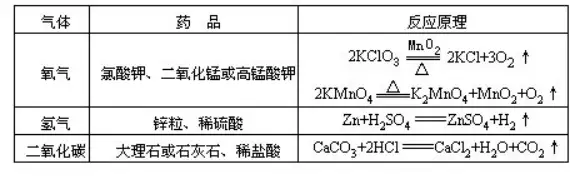
52.―θöβΚΆΕΰ―θΜ·ΧΦΒΡôzùMΖΫΖ®

53.―θöβ��ΓΔöδöβΚΆΕΰ―θΜ·ΧΦ÷Τ²δöβσw―b÷Ο
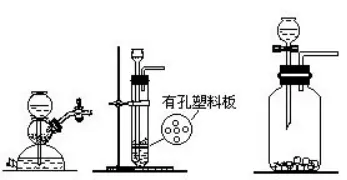
(1)―θöβ”ΟΙΧσw≈cΙΧσwΥéΤΖΜλΚœΦ”üαΒΡ―b÷Ο
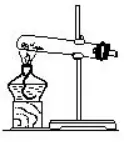
(2)öδöβΚΆΕΰ―θΜ·ΧΦ”ΟΙΧσw≈c“ΚσwΥéΤΖΜλΚœ≤ΜΦ”üαΒΡ―b÷Ο
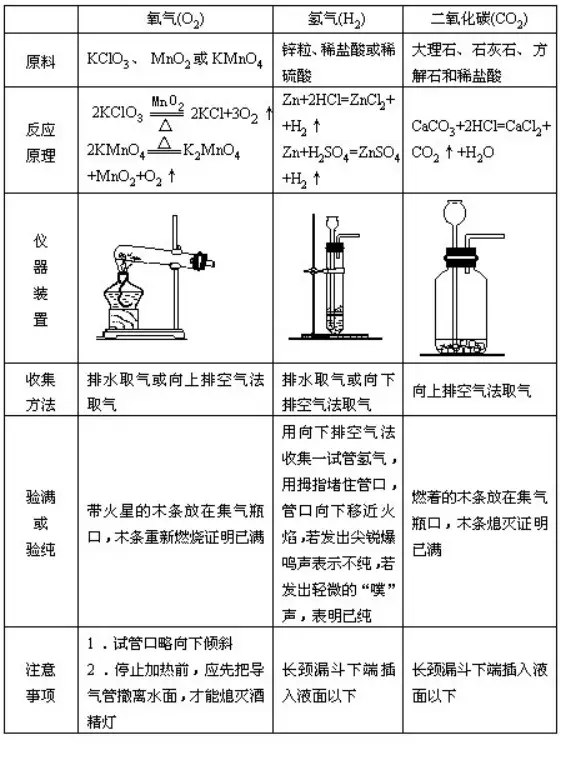
54.?¨çρû “÷Τ»Γ―θöβ��ΓΔöδöβ�ΓΔΕΰ―θΜ·ΧΦΒΡ±»ί^
55.ΥéΤΖΒΡ¥φΖ≈
ΑΉΝΉΘΚ“ρ“Ή―θΜ·«“ΡήΉ‘»ΦΘ§ΒΪΥϋ≤Μ≈cΥ°Ζ¥ëΣ(y®©ng)��Θ§Υυ“‘ëΣ(y®©ng)Ζ≈‘ΎΥ°÷–¥φΖ≈��ΓΘ
èä(qi®Δng)âAΘΚ»γöδ―θΜ·βc�ΓΔöδ―θΜ·β¦Β»ΓΘ“ρΥϋ²É“Ή≥±Ϋβ�ΓΔ“Ή≈cΕΰ―θΜ·ΧΦΖ¥ëΣ(y®©ng)Θ§”÷Ρή≈cΕΰ―θΜ·ΙηΖ¥ëΣ(y®©ng)ΕχΗ·Έg‘΅³©ΤΩΤΩΩΎ�Θ§Υυ“‘ëΣ(y®©ng)Ζ≈‘Ύ”ΟΡz»ϊΟήΖβΒΡ‘΅³©ΤΩÉ»(n®®i)ΓΘ
ùβœθΥαΘΚ“ρΨΏ”–™]Αl(f®Γ)–‘�Θ§“äΙβ ήüα“ΉΖ÷ΫβΘ§ëΣ(y®©ng)‘ΎΒΆ€ΊΧéΒΡΉΊ…ΪΤΩÉ»(n®®i)¥φΖ≈��ΓΘ
Α±Υ°ΘΚ“ρ“Ή™]Αl(f®Γ)��Θ§Υυ“‘ëΣ(y®©ng)Ζ≈‘ΎΒΆ€ΊΧé��Θ§ΟήΖβ‘Ύ‘΅³©ΤΩÉ»(n®®i)����ΓΘΑ±Υ°¨ΠΕύΖNΫπ¨Ό”–Η·ΈgΉς”ΟΘ§‘ΎΏ\(y®¥n)ίîΚΆΌA¥φΑ±Υ°ïr����Θ§“ΜΑψ“Σ”ΟœπΤΛ¥ϋ���ΓΔΧ’¥…â·ΜρÉ»(n®®i)ΆΩûr«ύΒΡηFΆΑΒ»ΡΆΗ·ΈgΒΡ»ίΤςΓΘ
Ϋπ¨Όβ¦��ΓΔβc����ΓΔβ}ΘΚ“ρΥϋ²É“Ή―θΜ·ΓΔ“ΉΗζΥ°Ζ¥ëΣ(y®©ng)�Θ§ΒΪΥϋ²É≤ΜΚΆΟΚ”ΆΜρ ·œû”ΆΖ¥ëΣ(y®©ng)Θ§Υυ“‘ëΣ(y®©ng)‘ΎΟΚ”ΆΜρ ·œû”Άάο¥φΖ≈�ΓΘ
œθΥαψyΘΚ“ρ“äΙβ ήüα“ΉΖ÷ΫβΘ§Υυ“‘ëΣ(y®©ng)‘ΎΒΆ€ΊΧéΉΊ…ΪΤΩÉ»(n®®i)¥φΖ≈����ΓΘ
ùβΝρΥα“ΉΈϋ ’Ω’öβ÷–ΒΡΥ°ΖίΘ§ùβϊ}Υα“Ή™]Αl(f®Γ)��Θ§ëΣ(y®©ng)Ζ≈»κ‘΅³©ΤΩάο”ΟΡΞΩΎ»ϊ…w΅ά(y®Δn)��ΓΘ
56.ôzρûΈοΌ|(zh®§)ΒΡ“ΜΑψ“é(gu®©)³t
(1)Ης»Γ…ΌΝΩ�Θ§Ζ÷³eΨéΧ•;
(2)ΙΧσwΈοΌ|(zh®§)Φ”Υ°»ήΫβ;
(3)Ζ÷³eΒΈΦ”‘΅³©;
(4)”^≤λ§F(xi®Λn)œσΘ§ΒΟ≥ωΫY(ji®Π)’™�ΓΘ
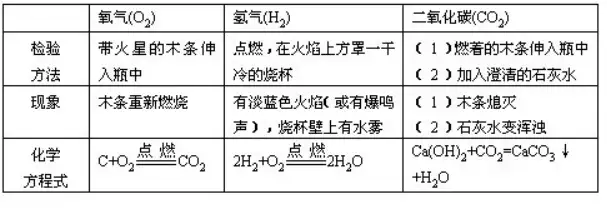
57.»ΐΖNöβσw(―θöβ�ΓΔöδöβΚΆΕΰ―θΜ·ΧΦ)ΒΡôzρû
58.éΉΖN÷Ί“ΣΈοΌ|(zh®§)ΒΡôzρû
ΓΓΓΓ ög”≠ Ι”Ο ÷ôC(j®©)����ΓΔΤΫΑεΒ»“Τ³”‘O(sh®®)²δ‘LÜ•÷–ΩΦΨW(w®Θng)�Θ§2024÷–ΩΦ“Μ¬Ζ≈ψΑιΆ§––ΘΓ>>ϋc™τ≤ιΩ¥