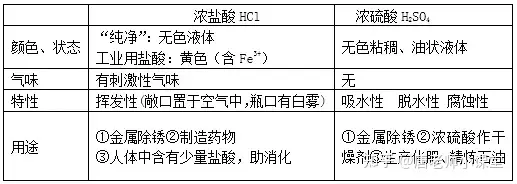
一�、酸及酸的化學(xué)性質(zhì)
酸在水溶液中能解離出氫離子(H+)和酸根離子�����。常見的酸有①鹽酸(HCl)②硫酸(H2SO4) ③硝酸(HNO3)④醋酸(CH3COOH)
①紫色石蕊試液遇酸變紅��,無色酚酞試液遇酸不變色��。
②活潑金屬+酸鹽+氫氣(注:此處酸不包括濃硫酸和硝酸)
Zn+H2SO4=ZnSO4+H2 Zn+2HCl=ZnCl2+H2
Fe+H2SO4=FeSO4+H2 Fe+2HCl=FeCl2+H2
2Al+3H2SO4=Al2(SO4)3+3H2
2Al+6HCl=2AlCl3+3H2
③金屬氧化物+酸鹽+水
Fe2O3+6HCl=2FeCl3+3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
CuO+H2SO4=CuSO4+H2O
CuO+2HCl=CuCl2+H2O
④堿+酸鹽+水
NaOH+HCl=NaCl+H2O
Ca(OH)2+H2SO4=CaSO4+2H2O
3HCl + Al(OH)3 = AlCl3 + 3H2O
⑤*鹽+酸新鹽+新酸
AgNO3+HCl=AgCl+HNO3
BaCl2+H2SO4=BaSO4+2HCl
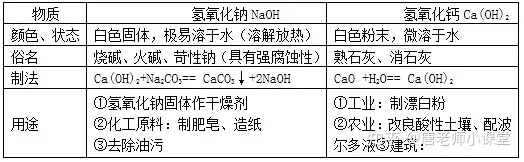
二��、堿及堿的化學(xué)性質(zhì)
堿由離子構(gòu)成�����,堿在水溶液中能解離出金屬離子和氫氧根離子(OH-)�����。
常見的堿有氫氧化鈉(NaOH) �、氫氧化鈣 Ca(OH)2、氨水(NH3·H2O)等��。
1.氫氧化鈉�、氫氧化鈣的物理性質(zhì)�、用途
2.堿的化學(xué)性質(zhì)
紫色石蕊試液遇堿溶液變藍(lán)�����,無色酚酞試液遇堿溶液變紅�。
①酸性氧化物+堿鹽+水
2NaOH+CO2=Na2CO3+H2O
*2NaOH+SiO2=Na2SiO3+H2O
Ca(OH)2+CO2=CaCO3+H2O
②酸+堿鹽+水(中和反應(yīng))
③*鹽+堿新鹽+新堿(反應(yīng)物均可溶)
2NaOH+CuSO4=Na2SO4+Cu(OH)2
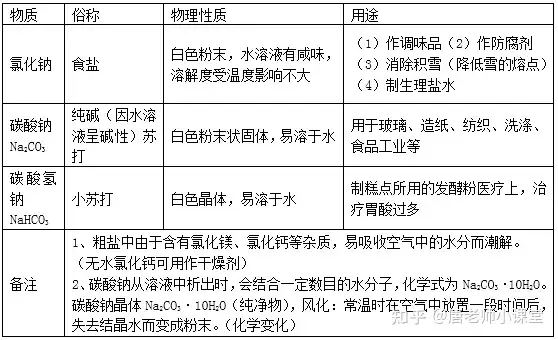
三、鹽的性質(zhì)
1.常見的鹽
鹽由離子構(gòu)成�,組成里含有金屬離子(或NH4+)和酸根離子的一類化合物。
2.粗鹽提純
去除粗鹽中不溶性雜質(zhì)��。
3.鹽的化學(xué)性質(zhì)
①鹽溶液+金屬新鹽+新金屬(按金屬活動(dòng)性順序)
CuSO4+Zn=ZnSO4+Cu
CaCO3+2HCl=CaCl2+H2O+CO2
Na2CO3+2HCl=2NaCl+H2O+CO2
NaHCO3+HCl=NaCl+H2O+CO2
鹽溶液+堿溶液新鹽+新堿(必有一個(gè)是沉淀)
Ca(OH)2+Na2CO3==CaCO3+2NaOH(明星反應(yīng))
3NaOH+FeCl3=3NaCl+Fe(OH)3
鹽溶液+鹽溶液新鹽+新鹽(必有一個(gè)是沉淀)
CaCl2+Na2CO3=CaCO3+2NaCl
AgNO3+NaCl=AgCl+NaNO3
四��、明確復(fù)分解反應(yīng)發(fā)生的本質(zhì)
復(fù)分解反應(yīng):由兩種化合物(通常為酸堿鹽)相互交換成分�����,生成另外兩種化合物的反應(yīng)�。
通式:AB+CD=AD+CB
發(fā)生的條件:生成物中如果有�、或有H2O(穩(wěn)定、難溶��、難電離物質(zhì))
注意:堿與氧化物的反應(yīng)不屬于復(fù)分解反應(yīng)
對于復(fù)分解反應(yīng)的三大特點(diǎn)也是同學(xué)們必須要記住的��,第一反應(yīng)物�,生成物均只有兩種化合物。第二,發(fā)生反應(yīng)的兩種化合物相互交換成分�,三個(gè)元素的化合價(jià)在反應(yīng)的前后均不發(fā)生改變,同學(xué)們在判斷是否是復(fù)分解反應(yīng)時(shí)�����,只需要依據(jù)以上的條即可辨別�。
五、熟記酸��、堿�、鹽的溶解性口訣
堿溶氨、鈉�����、鉀�����、鋇�����、鈣(俺拿假被蓋)
鉀鈉銨(銨鹽)硝(硝酸鹽)全都溶��。
硫酸鹽不溶鋇和鉛;氯化物不溶銀亞汞,碳酸鹽只溶鉀鈉銨��。
六�����、幾個(gè)常見離子的檢驗(yàn)
1.Cl-離子的檢驗(yàn) (選)
取少量樣品于試管中�����,滴加AgNO3溶液和稀HNO3有不溶于稀硝酸的白色沉淀生成�����,樣品含有Cl-�����, AgNO3+KCl=AgCl+KNO3
2.SO42-離子的檢驗(yàn) (選)
取少量樣品于試管中�,滴加Ba(NO3)2溶液和稀HNO3有不溶于稀硝酸的白色沉淀生成,樣品含有SO42-��, Ba(NO3)2+H2SO4=BaSO4+2HNO3
3. CO32-離子的檢驗(yàn)
取少量樣品于試管中��,滴加稀HCl�����,將生成的氣體通入澄清石灰水有無色氣體生成��,該氣體使澄清石灰水變渾濁�����,樣品含有CO32-�,
K2CO3+2HCl=2KCl+CO2+H2O
CO2+Ca(OH)2=CaCO3+H2O
4.檢驗(yàn)NH4+(選)
取少量待檢物于潔凈的試管中,滴入適量NaOH溶液并加熱�����,有使?jié)竦募t色石蕊試紙變成藍(lán)色的氣體產(chǎn)生�。
5、鑒別稀鹽酸和稀硫酸
分別取少量待檢液體于兩支潔凈的試管中��,各滴入幾滴BaCl2溶液�,有白色沉淀產(chǎn)生的原溶液是稀硫酸,無現(xiàn)象產(chǎn)生的原溶液是稀鹽酸��。
七�����、常見俗稱、成分和化學(xué)式
生石灰——CaO 熟石灰——Ca(OH)2
石灰石�、大理石——CaCO3食鹽——NaCl
火堿、燒堿�、苛性鈉——NaOH 純堿、蘇打——Na2CO3 小蘇打——NaHCO3
鐵銹��、赤鐵礦——Fe2O3 磁鐵礦——Fe3O4 金剛石�����、石墨——C 干冰——CO2 冰——H2O 天然氣(甲烷)——CH4
酒精(乙醇)——C2H5OH 醋酸(乙酸)——CH3COOH
八�����、常見物質(zhì)的顏色
紅色的固體——Cu�����、Fe2O3�、P(紅磷)
黑色的固體——C、CuO�、Fe3O4、FeO�����、MnO2
白色的固體——KClO3��、P2O5�����、P(白磷)�、CuSO4(無水硫酸銅)、KCl��、NaCl等
暗紫色的固體——KMnO4
淡黃色的固體——S
藍(lán)色晶體——CuSO4•5H2O
藍(lán)色沉淀——Cu(OH)2
紅褐色沉淀——Fe(OH)3
白色沉淀(不溶于酸)——BaSO4�����、AgCl
白色沉淀(碳酸鹽)——CaCO3�、BaCO3
白色沉淀(堿)——Mg(OH)2、Al(OH)3
藍(lán)色溶液——CuSO4�、Cu(NO3)2等含Cu2+溶液
淺綠色溶液——FeSO4、FeCl2等含F(xiàn)e2+溶液
棕黃色溶液——FeCl3、Fe2(SO4)3等含F(xiàn)e3+溶液
對于初中階段酸堿鹽的學(xué)習(xí),其包含的內(nèi)容量還是比較多的�����,那么在學(xué)習(xí)當(dāng)中想要快速的掌握這部分的內(nèi)容�����,那么對其全面的了解外��,還要針對每一部分的內(nèi)容進(jìn)行細(xì)致的分析�����,特別其中涉及到的一些簡單的實(shí)驗(yàn)?zāi)芤材軌驇椭蠹铱焖俚恼莆账釅A鹽各部分的性質(zhì)�����。其中重要的一些化學(xué)方程式�。記憶的口訣都是大家在學(xué)習(xí)或復(fù)習(xí)當(dāng)中比較重要的學(xué)習(xí)內(nèi)容。
歡迎使用手機(jī)�、平板等移動(dòng)設(shè)備訪問中考網(wǎng),2023中考一路陪伴同行��!>>點(diǎn)擊查看












