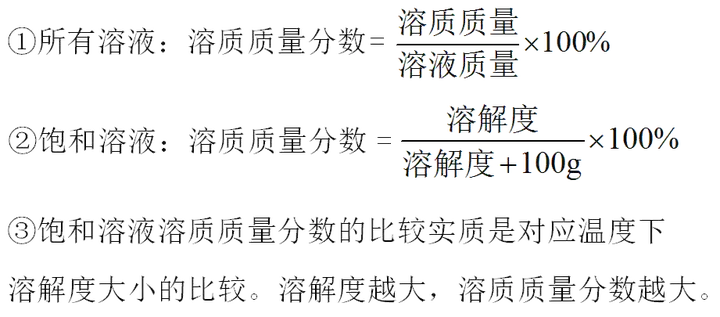-1-
“∆Ŗ◊žįň…ŗ”’f(shu®≠)Ņľ«ť
°Ų ÍÉőų÷–Ņľ’f(shu®≠)£ļĪōŅľ����°£∂ŗ“‘»‹Ĺ‚∂»«ķĺÄĹY(ji®¶)ļŌĆć(sh®™)őÔ≤Ŕ◊ųąDĽÚ’ŖĪŪłŮ–ő Ĺ√ŁÓ}£¨√ŅńÍŅľ≤ťĶń–ő Ĺĺý≤ĽŌŗÕ¨°£ĹŁ4 ńÍĺý‘ŕ18Ó}Ó}őĽŅľ≤ť°£
°Ų …Ĺőų÷–Ņľ’f(shu®≠)£ļÉH2017ńÍőīŅľ����°£≥ż2014ńÍ(»‹Ĺ‚∂»ĪŪ)�����°Ę2011ńÍ(1ól«ķĺÄ+Ćć(sh®™)őÔ≤Ŕ◊ųąD)Õ‚���£¨∆š”ŗĺý «Ņľ≤ť2∑Nőī÷™őÔŔ|(zh®¨)Ķń»‹Ĺ‚∂»«ķĺÄ�°£ÉH2016ńÍ‘ŕĆć(sh®™)Úě(y®§n)ŐĹĺŅÓ}÷–Ņľ≤ť�£¨∆š”ŗĺý‘ŕŐÓŅ’Ó}÷–Ņľ≤ť°£
°Ų ļ”ńŌ÷–Ņľ’f(shu®≠)£ļĪōŅľ���°£ ≥ż2015ńÍ(»‹Ĺ‚∂»ĪŪ)����°Ę2010ńÍ(“Ľ∑Nőī÷™őÔŔ|(zh®¨)Ķń»‹Ĺ‚∂»«ķĺÄ)£¨∆š”ŗĺý «Ņľ≤ťÉ…∑Nőī÷™őÔŔ|(zh®¨)Ķń»‹Ĺ‚∂»«ķĺÄ��°£
°Ų ļ”ĪĪ÷–Ņľ’f(shu®≠)£ļÉH2010ńÍőīŅľ�°£≥£‘ŕŖxďŮÓ}÷–“‘»‹Ĺ‚∂»«ķĺÄĶń–ő ĹŖM(j®¨n)––Ņľ≤ť£¨Ňľ†Ė“≤ēĢ(hu®¨)“‘őń◊÷√Ť ŲĽÚ»‹Ĺ‚∂»ĪŪłŮĶń–ő ĹŖM(j®¨n)––Ņľ≤ť����°£
°Ų ‘∆ńŌ÷–Ņľ’f(shu®≠)£ļĪōŅľ���°£‘ŕŖxďŮÓ}�����°ĘŐÓŅ’ŇcļÜ(ji®£n)īū÷–ĺý”–…śľį��°£∂ŗ“‘»żólĽÚÉ…ól«ķĺÄĶń–ő ĹŅľ≤ť��£¨Ķę «Ňľ†Ė“≤ēĢ(hu®¨)“‘“Ľól«ķĺÄĶń–ő ĹŅľ≤ťŌŗÍP(gu®°n)÷™◊R(sh®™)���°£
°Ų į≤Ľ’÷–Ņľ’f(shu®≠)£ļĪōŅľ°����£Ņľ≤ť–ő Ĺ∂ŗė”���£¨Ņľ≤ť“Ľól«ķĺÄēr(sh®™)£¨«ķĺÄ◊ŖĄ›(sh®¨)”–“÷Ľ…Ō…żļÕŌ»…żļůĹĶ”–Õ;Ņľ≤ťÉ…ól«ķĺÄēr(sh®™)�£¨«ķĺÄ◊ŖĄ›(sh®¨)”–“2…ż”°Ę“1…ż1ĹĶ”ļÕ“2ĹĶ”–Õ����°£
°Ų Ĺ≠őų÷–Ņľ’f(shu®≠)£ļĪōŅľ°£ «ķĺÄĶń–ő ĹįŁņ®“1 …ż 1 ĹĶ”��°Ę“2…ż”����°Ę“2…ż1ĹĶ”Ķ»°£“≤ēĢ(hu®¨)“‘«ķĺÄĹY(ji®¶)ļŌĪŪłŮ–ő Ĺ�����£¨ĽÚÜő™ö(d®≤)“‘≤Ŕ◊ųąDĶń–ő ĹŅľ≤ť��°£
-2-
’f(shu®≠)ĀŪ(l®Ęi)’f(shu®≠)»•ŖÄĶ√ĺö
1. (Õ∆ň]‘∆ńŌ�����°Ęį≤Ľ’°ĘĹ≠őų�����°Ęļ”ĪĪ) ľ◊��°Ę““É…ĻŐůwőÔŔ|(zh®¨)Ķń»‹Ĺ‚∂»«ķĺÄ»ÁąDňý ĺ�����£¨Ō¬Ń–’f(shu®≠)∑®Śe(cu®į)’`Ķń «( )
ľ◊�°Ę““É…őÔŔ|(zh®¨)Ķń»‹Ĺ‚∂»ĺýŽSúō∂»Ķń…żłŖ∂Ý‘Ųīů
t1°śēr(sh®™)���£¨ľ◊őÔŔ|(zh®¨)Ķń»‹Ĺ‚∂»ļÕ““őÔŔ|(zh®¨)Ķń»‹Ĺ‚∂»ŌŗĶ»
t1°śēr(sh®™)�£¨ľ◊őÔŔ|(zh®¨)ļÕ““őÔŔ|(zh®¨)ĶńÔĖļÕ»‹“ļĶń»‹Ŕ|(zh®¨)Ŕ|(zh®¨)ŃŅ∑÷?j®ęn)?sh®ī)ĺýěť30%
t2°śēr(sh®™)�£¨““őÔŔ|(zh®¨)ĶńÔĖļÕ»‹“ļĹĶúōļůēĢ(hu®¨)”–ĺßůwőŲ≥Ų
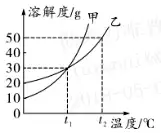
2. (Õ∆ň]ļ”ńŌ°Ęļ”ĪĪ) a�����°ĘbÉ…őÔŔ|(zh®¨)‘ŕ≤ĽÕ¨úō∂»ēr(sh®™)Ķń»‹Ĺ‚∂»»ÁĪŪňý ĺ����£¨łýďĢ(j®ī)ĪŪ÷––ŇŌĘ�£¨Ň–ĒŗŌ¬Ń–’f(shu®≠)∑®≤Ľ’żī_Ķń « ( )
20°śēr(sh®™)��£¨ŌÚ100 gňģ÷–ľ”»Ž25 gĻŐůwa��£¨ňýĶ√»‹“ļŔ|(zh®¨)ŃŅ «125 g
bőÔŔ|(zh®¨)Ķń»‹Ĺ‚∂»ŽSúō∂»Ķń…żłŖ∂Ýúp–°
50°śēr(sh®™)�£¨100 g bőÔŔ|(zh®¨)ĶńÔĖļÕ»‹“ļ÷–”–
18.7 g bőÔŔ|(zh®¨)
ĆĘ30°śēr(sh®™)£¨a��°ĘbÉ…őÔŔ|(zh®¨)ĶńÔĖļÕ»‹“ļÕ¨ēr(sh®™)ĹĶúō÷Ń20°ś�£¨ňýĶ√»‹“ļĶń»‹Ŕ|(zh®¨)Ŕ|(zh®¨)ŃŅ∑÷?j®ęn)?sh®ī)Ķńīů–°ÍP(gu®°n)ŌĶ «a>b
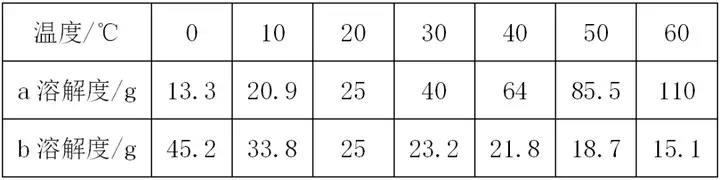
3. (Õ∆ň]‘∆ńŌ°Ęį≤Ľ’) »ÁąD «“Ľ∑NĻŐůwőÔŔ|(zh®¨)(≤Ľļ¨ĹY(ji®¶)ĺßňģ)Ķń»‹Ĺ‚∂»«ķĺÄ��°£ Ō¬Ń–’f(shu®≠)∑®Śe(cu®į)’`Ķń «( )
60°śēr(sh®™)‘ďőÔŔ|(zh®¨)Ķń»‹Ĺ‚∂»ěť40 g
‘ďőÔŔ|(zh®¨)Ķń»‹Ĺ‚∂»ŽSúō∂»Ķń…żłŖ∂Ýúp–°
PŁc(di®£n)ĪŪ ĺ60°śēr(sh®™)‘ďőÔŔ|(zh®¨)Ķń≤ĽÔĖļÕ»‹“ļ
Ņ…“‘Õ®Ŗ^(gu®į)ĹĶúōĹY(ji®¶)ĺßĶń∑Ĺ∑®ŐŠľÉ?c®®)ďőÔŔ|(zh®¨)
4. (Õ∆ň]Ĺ≠őų) A�°ĘB°ĘC»ż∑NőÔŔ|(zh®¨)Ķń»‹Ĺ‚∂»«ķĺÄ»ÁąDňý ĺ����£¨’ą(q®ęng)ĽōīūŌ¬Ń–ÜĖ(w®®n)Ó}°£
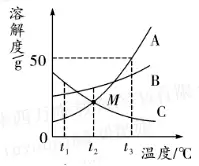
(1)t1°śēr(sh®™)���£¨ A���°ĘB���°ĘC»ż∑NőÔŔ|(zh®¨)Ķń»‹Ĺ‚∂»”…īůĶĹ–°ĶńŪė–Ú «______°£
(2)t3°śēr(sh®™)į—50g A ∑Ň»Ž50gňģ÷–Ķ√ĶĹAĶń______(ŐÓ“ÔĖļÕ”ĽÚ“≤ĽÔĖļÕ”)»‹“ļ����£¨īňēr(sh®™)»‹“ļ÷–»‹Ŕ|(zh®¨)ļÕ»‹“ļĶńŔ|(zh®¨)ŃŅĪ»ěť______°£
(3)ĆĘt3°ś ēr(sh®™)���£¨A��°ĘB�°ĘC»ż∑NőÔŔ|(zh®¨)ĶńÔĖļÕ»‹“ļĹĶúō÷Ńt2°ś,ňýĶ√»‹“ļĶń»‹Ŕ|(zh®¨)Ŕ|(zh®¨)ŃŅ∑÷?j®ęn)?sh®ī)Ķńīů–°ÍP(gu®°n)ŌĶ «______�°£
5. (Õ∆ň]ÍÉőų) »ÁąD «ŌűňŠ‚õļÕ¬»ĽĮ‚c‘ŕ≤ĽÕ¨úō∂»ēr(sh®™)Ķń»‹Ĺ‚∂»«ķĺÄ£¨Ō¬ĪŪ «É…∑NőÔŔ|(zh®¨)‘ŕ≤Ņ∑÷úō∂»ēr(sh®™)Ķń»‹Ĺ‚∂»ĒĶ(sh®ī)ďĢ(j®ī)���°£
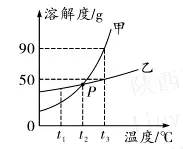
(1)łýďĢ(j®ī)»‹Ĺ‚∂»ĪŪłŮŅ…÷™�����£¨»‹Ĺ‚∂»«ķĺÄąD÷–ľ◊ĪŪ ĺ_______Ķń»‹Ĺ‚∂»«ķĺÄ°£
(2)»Űľ◊őÔŔ|(zh®¨)÷–Ľž”–…ŔŃŅĶń““őÔŔ|(zh®¨)��£¨ŐŠľÉľ◊őÔŔ|(zh®¨)◊Óļ√≤…»°Ķń∑Ĺ∑® «____(ŐÓ“ ĹĶúōĹY(ji®¶)ĺß”ĽÚ“ ’Űįl(f®°)ĹY(ji®¶)ĺß”)�°£
(3)ĆĘt1°ś Ķńľ◊����°Ę““É…őÔŔ|(zh®¨)ĶńÔĖļÕ»‹“ļ(ĺýüo(w®≤)ĻŐůwőÔŔ|(zh®¨) £”ŗ) …żúōĶĹt2°ś ēr(sh®™)�����£¨ňýĶ√ľ◊őÔŔ|(zh®¨)»‹“ļĶń»‹Ŕ|(zh®¨)Ŕ|(zh®¨)ŃŅ∑÷?j®ęn)?sh®ī)____(ŐÓ“īů”ŕ”��°Ę“–°”ŕ”ĽÚ“Ķ»”ŕ”)““őÔŔ|(zh®¨)»‹“ļĶń»‹Ŕ|(zh®¨)Ŕ|(zh®¨)ŃŅ∑÷?j®ęn)?sh®ī)�����°£
6. (Õ∆ň]Ĺ≠őų) t1°śēr(sh®™)���£¨ĆĘĶ»Ŕ|(zh®¨)ŃŅĶńľ◊����°Ę““É…∑NĻŐůwőÔŔ|(zh®¨)���£¨∑÷Ąeľ”»ŽĶĹ Ę”–100 gňģĶńüżĪ≠÷–�����£¨≥š∑÷?j®ęn)áįŤļů¨F(xi®§n)Ōů»ÁąD1��£¨ľ”üŠ÷Ńt2°śēr(sh®™)¨F(xi®§n)Ōů»ÁąD2���°£ľ◊�°Ę““����°ĘĪŻ»ż∑NőÔŔ|(zh®¨)Ķń»‹Ĺ‚∂»«ķĺÄ»ÁąD3°£ ’ą(q®ęng)ĹY(ji®¶)ļŌąD ĺĽōīūŌ¬Ń–ÜĖ(w®®n)Ó}£ļ
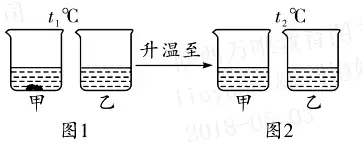
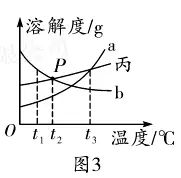
(1)∑÷őŲąD1ļÕąD2÷–Ķń¨F(xi®§n)Ōů�����£¨Ň–Ēŗ∑ŻļŌľ◊őÔŔ|(zh®¨)Ķń»‹Ĺ‚∂»«ķĺÄ «ąD3÷–Ķń____(ŖxŐÓ“a”ĽÚ“b”);ąD÷–PŁc(di®£n)ĪŪ ĺĶńļ¨Ńx «______����°£
(2)t1°śēr(sh®™)£¨ľ◊����°Ę““°ĘĪŻĶńÔĖļÕ»‹“ļĶń»‹Ŕ|(zh®¨)Ŕ|(zh®¨)ŃŅ∑÷?j®ęn)?sh®ī)Źń–°ĶĹīůĶńŪė–Ú «_____�����°£
(3)t3°śēr(sh®™)�£¨ĆĘĶ»Ŕ|(zh®¨)ŃŅĶńľ◊°Ę““�����°ĘĪŻĶńÔĖļÕ»‹“ļĹĶúōĶĹt1°ś���£¨“Ľ∂®”–ĺßůwőŲ≥ŲĶń « _____ �°£
7. (Õ∆ň]ÍÉőų) Ō¬ĪŪ « a�°ĘbÉ…őÔŔ|(zh®¨)‘ŕ≤ĽÕ¨úō∂»ēr(sh®™)Ķń»‹Ĺ‚∂»£¨∑÷őŲĪŪ÷–ĒĶ(sh®ī)ďĢ(j®ī)�£¨ĽōīūÜĖ(w®®n)Ó}°£
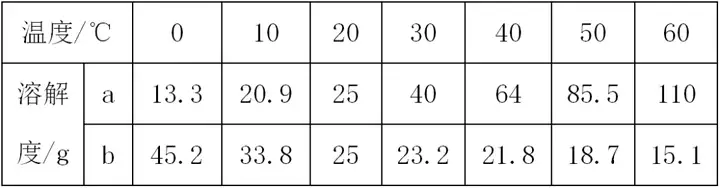
(1)20°śēr(sh®™)���£¨ŌÚ 50 gňģ÷–ľ”»Ž25 gĶńĻŐůwa�����£¨ňýĶ√»‹“ļŔ|(zh®¨)ŃŅ «_____g�����°£
(2)ĆĘ30°śēr(sh®™)���£¨a���°ĘbÉ…őÔŔ|(zh®¨)ĶńÔĖļÕ»‹“ļÕ¨ēr(sh®™)…żúō÷Ń40°ś£¨ňýĶ√»‹“ļĶń»‹Ŕ|(zh®¨)Ŕ|(zh®¨)ŃŅ∑÷?j®ęn)?sh®ī)Ķńīů–°ÍP(gu®°n)ŌĶ «a____b(ŐÓ“>”�°Ę“<”ĽÚ“=”)°£
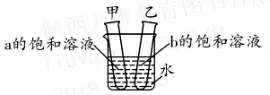
(3)»ÁąDňý ĺ�£¨¨F(xi®§n)”–20°śēr(sh®™)Ķ»Ŕ|(zh®¨)ŃŅĶńa°ĘbÉ…őÔŔ|(zh®¨)ĶńÔĖļÕ»‹“ļ��£¨ŌÚüżĪ≠Ķńňģ÷–ľ”»Ž“Ľ∂®ŃŅĶńŌűňŠš@��£¨»‹Ĺ‚ļůľ◊‘áĻ‹É»(n®®i)≥Ų¨F(xi®§n)Ķń¨F(xi®§n)Ōů «_____;““‘áĻ‹É»(n®®i)Ķń»‹“ļ «_____(ŐÓ“ÔĖļÕ”ĽÚ“≤ĽÔĖļÕ”)»‹“ļ�����°£
°ĺīūįł°Ņ
1.C 2.C 3.B
4.(1)C>B>A (2)ÔĖļÕ 1:3
(3)B>A>C
5.(1)ŌűňŠ‚õ(ĽÚKNO3) (2)ĹĶúōĹY(ji®¶)ĺß
(3)–°”ŕ
6.(1)a t2°śēr(sh®™)�����£¨““ļÕĪŻĶń»‹Ĺ‚∂»ŌŗĶ»
(2)ľ◊ < ĪŻ < ““
(3)ľ◊ļÕĪŻ
7.(1)62.5 (2)>
(3)”–ĺßůwőŲ≥Ų ≤ĽÔĖļÕ
-3-
Ć£ľ“√ō’–ŕsĺoŅī
“Ľ���°Ę»‹Ĺ‚∂»«ķĺÄ
“™Łc(di®£n)1£ļ»‹Ĺ‚∂»ŽSúō∂»Ķń◊ÉĽĮŕÖĄ›(sh®¨)
✪
»Á£ļľ◊���°Ę““Ķń»‹Ĺ‚∂»ĺýŽSúō∂»Ķń…żłŖ∂Ý‘Ųīů£¨ĪŻĶń»‹Ĺ‚∂»ŽSúō∂»Ķń…żłŖ∂Ýúp–° °£
°Ų ∑Ĺ∑®÷łĆß(d®£o)£ļŅī«ķĺÄĶń∆¬∂»ľį◊ŖŌÚ�£¨Źń◊ůĶĹ”“Ņī«ķĺÄĶń◊ŖĄ›(sh®¨) «ŌÚ…Ō��°ĘŌÚŌ¬ŖÄ «∆ĹĺŹ�����°£ŌÚ…ŌĪŪ ĺŽSúō∂»…żłŖ»‹Ĺ‚∂»‘Ųīů(»Áľ◊�����°Ę““);∆ĹĺŹĪŪ ĺŽSúō∂»…żłŖ»‹Ĺ‚∂»‘ŲīůĶńŕÖĄ›(sh®¨)≤ĽÔ@÷Ý(»Á““);ŌÚŌ¬ĪŪ ĺŽSúō∂»…żłŖ»‹Ĺ‚∂»úp–°(»ÁĪŻ)�����°£
“™Łc(di®£n)2£ļ »‹Ĺ‚∂»«ķĺÄĹĽŁc(di®£n)Ķńļ¨Ńx
✪
»Á£ļPŁc(di®£n)ĪŪ ĺ£ļt3°śēr(sh®™)��£¨ľ◊�°Ę““Ķń»‹Ĺ‚∂»ŌŗĶ»£¨ĺýěť50 g ����°£
°Ų ∑Ĺ∑®÷łĆß(d®£o)£ļ«ķĺÄĹĽŁc(di®£n)ĪŪ ĺ‘ďúō∂»ēr(sh®™)£¨É…∑NőÔŔ|(zh®¨)Ķń»‹Ĺ‚∂»ŌŗĶ»��£¨īňēr(sh®™)É…∑NőÔŔ|(zh®¨)ÔĖļÕ»‹“ļĶń»‹Ŕ|(zh®¨)Ŕ|(zh®¨)ŃŅ∑÷?j®ęn)?sh®ī)“≤ŌŗÕ¨°£√Ť ŲÉ…ól»‹Ĺ‚∂»«ķĺÄĹĽŁc(di®£n)ňýĪŪ ĺĶń“‚Ńxēr(sh®™)“™÷ł√ųúō∂»���°£
“™Łc(di®£n)3£ļ»‹Ĺ‚∂»īů–°ĶńŇ–ĒŗŇcĪ»›^
✪
»Á£ļt1°śēr(sh®™)���£¨»ż∑NőÔŔ|(zh®¨)Ķń»‹Ĺ‚∂»”…īůĶĹ–°ĶńŪėěť£ļĪŻ>““>ľ◊ °£
°Ų ∑Ĺ∑®÷łĆß(d®£o)£ļőÔŔ|(zh®¨)»‹Ĺ‚∂»īů–°ĶńĪ»›^Žx≤Ľť_úō∂»�����°£Ŗ^(gu®į)‘ďúō∂»Ć¶(du®¨)Ď™(y®©ng)ĶńŁc(di®£n)◊ųīĻ÷Ī”ŕôM›SĶń÷ĪĺÄ�����£¨Ņī÷ĪĺÄƶ(du®¨)Ď™(y®©ng)ĶńĹĽŁc(di®£n)ĶńŅv◊Ýėň(bi®°o)£ļĘŔ‘ďŅv◊Ýėň(bi®°o)ěťīňúō∂»Ō¬Ć¶(du®¨)Ď™(y®©ng)őÔŔ|(zh®¨)Ķń»‹Ĺ‚∂»�°£ĘŕŠėƶ(du®¨)É…∑NĽÚÉ…∑N“‘…ŌőÔŔ|(zh®¨)»‹Ĺ‚∂»īů–°ĶńĪ»›^£¨Ņv◊Ýėň(bi®°o)‘Ĺīů���£¨»‹Ĺ‚∂»‘Ĺīů�����°£
“™Łc(di®£n)4£ļÔĖļÕ»‹“ļŇc≤ĽÔĖļÕ»‹“ļĶńŇ–ĒŗľįŌŗĽ•řD(zhu®£n)ĽĮ
✪
»Á£ļĘŔt1°śēr(sh®™)�����£¨ĆĘ25 gľ◊őÔŔ|(zh®¨)ľ”»ŽĶĹ100 gňģ÷–�����£¨«°ļ√–ő≥…ľ◊ĶńÔĖļÕ»‹“ļ��°£Ęŕľ◊ĶńÔĖļÕ»‹“ļ…żúōļů◊É≥…≤ĽÔĖļÕ»‹“ļ���°£
°Ų ∑Ĺ∑®÷łĆß(d®£o)£ļ
‘ŕ“Ľ∂®úō∂»Ō¬£ļ

ÔĖļÕ»‹“ļŇc≤ĽÔĖļÕ»‹“ļĶńřD(zhu®£n)ĽĮ£ļ
ĘŔ»‹Ĺ‚∂»ŽSúō∂»Ķń…żłŖ∂Ý‘Ųīů£¨Ąt

Ę໋ł∂»ŽSúō∂»Ķń…żłŖ∂Ýúp–°����£¨Ąt

✪ “™Łc(di®£n)5£ļ »‹“ļ»‹Ŕ|(zh®¨)Ŕ|(zh®¨)ŃŅ∑÷?j®ęn)?sh®ī)Ķń”č(j®¨)ň„ŇcĪ»›^
»Á£ļt1°śēr(sh®™)£¨ĆĘ40 gĪŻľ”»ŽĶĹ100 gňģ÷–����£¨≥š∑÷»‹Ĺ‚,ňýĶ√»‹“ļĶń»‹Ŕ|(zh®¨)Ŕ|(zh®¨)ŃŅ∑÷?j®ęn)?sh®ī)ěť28.6%;t2°śēr(sh®™)£¨ľ◊ĶńÔĖļÕ»‹“ļĶń»‹Ŕ|(zh®¨)Ŕ|(zh®¨)ŃŅ∑÷?j®ęn)?sh®ī)ěť20% �����°£
°Ų ∑Ĺ∑®÷łĆß(d®£o)£ļ”č(j®¨)ň„Ļę Ĺ–Ť÷Ē(j®ęn)”õ£ļ
“™Łc(di®£n)6£ļŇ–ĒŗőÔŔ|(zh®¨)ĹY(ji®¶)ĺßĶń∑Ĺ∑®
✪

“™Łc(di®£n)7£ļ úō∂»łń◊Éēr(sh®™)����£¨»‹“ļ÷–łų∑NŃŅĶń◊ÉĽĮ«ťõr
✪
»Á£ļt3°śēr(sh®™)£¨ĆĘŌŗÕ¨Ŕ|(zh®¨)ŃŅĶńľ◊°Ę““��°ĘĪŻĶńÔĖļÕ»‹“ļÕ¨ēr(sh®™)ĹĶúōĶĹt1°ś�����£¨ĄtŌ¬Ń–’f(shu®≠)∑®’żī_Ķń «(C )
A. »‹Ŕ|(zh®¨)Ŕ|(zh®¨)ŃŅ∑÷?j®ęn)?sh®ī)£ļ““<ĪŻ
B. »‹Ą©Ŕ|(zh®¨)ŃŅ£ļľ◊>““
C. »‹Ŕ|(zh®¨)Ŕ|(zh®¨)ŃŅ£ļ““>ĪŻ
D. »‹“ļŔ|(zh®¨)ŃŅ£ļľ◊>ĪŻ
°Ų ∑Ĺ∑®÷łĆß(d®£o)£ļÔĖļÕ»‹“ļúō∂»◊ÉĽĮēr(sh®™)£ļ
(1)őÔŔ|(zh®¨)Ķń»‹Ĺ‚∂»ŽSúō∂»Ķń…żłŖ∂Ý‘Ųīů(ľī«ķĺÄěť…Ō…ż–Õ)���°£
ĘŔ »ŰĆĘÔĖļÕ»‹“ļĹĶĶÕúō∂»�����£¨”…”ŕőŲ≥Ųĺßůw���£¨»‹“ļ÷–»‹Ŕ|(zh®¨)Ŕ|(zh®¨)ŃŅúp–°£¨»‹Ą©Ŕ|(zh®¨)ŃŅ≤Ľ◊É����£¨»‹“ļŔ|(zh®¨)ŃŅúp–°£¨“Úīň»‹Ŕ|(zh®¨)Ŕ|(zh®¨)ŃŅ∑÷?j®ęn)?sh®ī)◊É–°�°£
Ęŕ »ŰĆĘÔĖļÕ»‹“ļ…żłŖúō∂»£¨ÔĖļÕ»‹“ļ◊É?y®≠u)ť≤ĽÔĖļÕ»‹“ļ�£¨»‹“ļ÷–»‹Ŕ|(zh®¨)°Ę»‹Ą©Ŕ|(zh®¨)ŃŅĺý≤Ľ◊É��£¨“Úīň»‹Ŕ|(zh®¨)Ŕ|(zh®¨)ŃŅ∑÷?j®ęn)?sh®ī)“≤≤Ľ◊É°£
(2)őÔŔ|(zh®¨)Ķń»‹Ĺ‚∂»ŽSúō∂»…żłŖ∂Ýúp–°(ľī«ķĺÄěťŌ¬ĹĶ–Õ)�°£łń◊Éúō∂»ēr(sh®™)£¨»‹“ļ÷–»‹Ŕ|(zh®¨)�����°Ę»‹Ą©����°Ę»‹“ļĶńŔ|(zh®¨)ŃŅ��£¨»‹Ŕ|(zh®¨)Ŕ|(zh®¨)ŃŅ∑÷?j®ęn)?sh®ī)◊ÉĽĮ«ťõrŇc…Ō Ų∑÷őŲŌŗ∑ī����°£
∂Ģ°Ę»‹Ĺ‚∂»«ķĺÄ
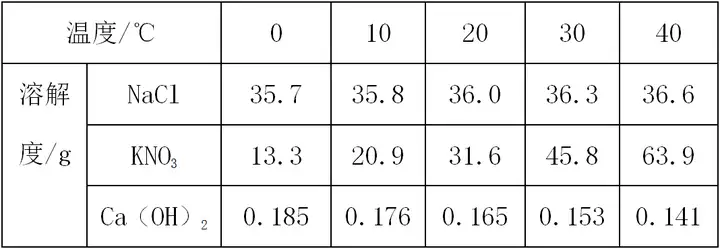
“™Łc(di®£n)1£ļŹńĪŪ÷–÷ĪĹ”◊x»°–ŇŌĘ
✪
(1)Õ¨“ĽőÔŔ|(zh®¨)����£¨≤ĽÕ¨úō∂»Ō¬Ķń»‹Ĺ‚∂»°£
»Á¬»ĽĮ‚c‘ŕ10°śēr(sh®™)»‹Ĺ‚∂»ěť35.8g����£¨‘ŕ30°śēr(sh®™)»‹Ĺ‚∂»ěť36.3g°£
(2)≤ĽÕ¨őÔŔ|(zh®¨)���£¨‘ŕÕ¨“Ľúō∂»Ō¬Ķń»‹Ĺ‚∂»�����°£
»Á20°śēr(sh®™)�����£¨¬»ĽĮ‚cĶń»‹Ĺ‚∂»ěť36.0 g�����£¨ŌűňŠ‚õĶń»‹Ĺ‚∂»ěť31.6g��£¨öš—űĽĮ‚}Ķń»‹Ĺ‚∂»ěť0.165 g��°£
(3)łýďĢ(j®ī)≤ĽÕ¨úō∂»Ō¬»‹Ĺ‚∂»Ķń◊ÉĽĮ«ťõr���£¨Ň–ĒŗőÔŔ|(zh®¨)Ķń»‹Ĺ‚∂»ŽSúō∂»Ķń◊ÉĽĮŕÖĄ›(sh®¨)�°£ »Á¬»ĽĮ‚cĶń»‹Ĺ‚∂»◊ÉĽĮŕÖĄ›(sh®¨)읎Súō∂»…żłŖ���£¨»‹Ĺ‚∂»‘Ųīů����£¨Ķę «∑ý∂»›^–°;ŌűňŠ‚õĶń»‹Ĺ‚∂»◊ÉĽĮŕÖĄ›(sh®¨)읎Súō∂»…żłŖ‘ŲťL(zh®£ng)∑ý∂»›^īů;öš—űĽĮ‚}Ķń»‹Ĺ‚∂»◊ÉĽĮŕÖĄ›(sh®¨)읎Súō∂»‘Ųīů∂Ýúp–° °£(ÉH◊ÉĽĮŕÖĄ›(sh®¨)�°Ę≤Ľ◊ŲĒĶ(sh®ī)ďĢ(j®ī)ƶ(du®¨)Ī»)
“™Łc(di®£n)2£ļ»‹Ĺ‚∂»ĪŪĶńĎ™(y®©ng)”√
✪
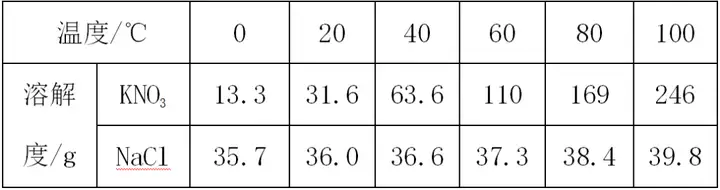
“‘ĪŪłŮĒĶ(sh®ī)ďĢ(j®ī)–ő ĹŅľ≤ťÉ…∑NőÔŔ|(zh®¨)(»ÁNaClļÕKNO3)»‹Ĺ‚∂»ŌŗĶ»Ķńúō∂»∑∂áķěť20°ś°ę 30°ś °£
°Ų ∑Ĺ∑®÷łĆß(d®£o)£ļłýďĢ(j®ī)»‹Ĺ‚∂»ĪŪ,Õ®Ŗ^(gu®į)ƶ(du®¨)Ī»É…∑NőÔŔ|(zh®¨)Ķń»‹Ĺ‚∂»����£¨20°ś“‘«į£¨NaClĶń»‹Ĺ‚∂»īů”ŕKNO3��£¨30°ś“‘ļů����£¨NaClĶń»‹Ĺ‚∂»–°”ŕKNO3£¨ĄtNaClļÕKNO3 »‹Ĺ‚∂»ŌŗĶ»Ķńúō∂»∑∂áķ“Ľ∂®‘ŕ20°ś°ę 30°ś÷ģťg�����°£
°°°° ög”≠ Ļ”√ ÷ôC(j®©)�°Ę∆ĹįŚĶ»“∆Ą”(d®įng)‘O(sh®®)āš‘LÜĖ(w®®n)÷–ŅľĺW(w®£ng)�£¨2024÷–Ņľ“Ľ¬∑Ň„įťÕ¨––£°>>Łc(di®£n)ďŰ≤ťŅī