ΈοΌ|(zh®§)ΒΡΉÉΜ·ΚΆ–‘Ό|(zh®§)
1ΓΔΈοάμΉÉΜ·ΚΆΜ·¨W(xu®Π)ΉÉΜ·
(1)ΈοάμΉÉΜ· «¦]”–…ζ≥…ΤδΥϊΈοΌ|(zh®§)ΒΡΉÉΜ·;
(2)ΈοάμΉÉΜ·Κξ”^…œ¦]”––¬ΈοΌ|(zh®§)…ζ≥…Θ§ΈΔ”^…œ¦]”––¬Ζ÷Ή”…ζ≥…����Γ���ΘΜ·¨W(xu®Π) Ϋ«ΑΚσ“ΜΕ®“Μ‰”��ΓΘ
(3)Μ·¨W(xu®Π)ΉÉΜ· «ΉÉΜ·ïr(sh®Σ)…ζ≥…ΝΥΤδΥϊΈοΌ|(zh®§)ΒΡΉÉΜ·���ΓΘ
(4)Μ·¨W(xu®Π)ΉÉΜ·Κξ”^…œ”––¬ΈοΌ|(zh®§)…ζ≥…����Θ§ΈΔ”^…œ”––¬Ζ÷Ή”…ζ≥…Γ����ΘΜ·¨W(xu®Π) Ϋ«ΑΚσ≤Μ“ΜΕ®≤Μ“Μ‰”(Ϋπ³² ·ΉÉ≥… ·ΡΪ≥ΐΆβ)ΓΘ
(5)Ö^(q®±)³eΘΚA�ΓΔèΡΚξ”^…œΩ¥Θ§ «Ζώ…ζ≥…ΝΥΤδΥϊΒΡΈοΌ|(zh®§)��ΓΘ
B�ΓΔèΡΈΔ”^…œΩ¥Θ§Αl(f®Γ)…ζΈοάμΉÉΜ·ïr(sh®Σ)�����Θ§÷Μ «‰΄(g®Αu)≥…ΈοΌ|(zh®§)ΒΡΝΘΉ”(Ζ÷Ή”���ΓΔ‘≠Ή”�ΓΔκxΉ”)÷°ιgΒΡιgΗτΑl(f®Γ)…ζΝΥΗΡΉÉΘ§ΝΘΉ”ΒΡ±Ψ…μ¦]”–Αl(f®Γ)…ζΗΡΉÉ;Αl(f®Γ)…ζΜ·¨W(xu®Π)ΉÉΜ·ïr(sh®Σ)��Θ§‰΄(g®Αu)≥…ΈοΌ|(zh®§)ΒΡΖ÷Ή”ΤΤΝ―����Θ§‘≠Ή”÷Ί–¬ΫMΚœ≥…–¬ΒΡΖ÷Ή”Θ§‰΄(g®Αu)≥…–¬ΒΡΈοΌ|(zh®§)�ΓΘ
(6)¬™(li®Δn)œΒΘΚ‘ΎΜ·¨W(xu®Π)ΉÉΜ·Ώ^≥Χ÷–Θ§“ΜΕ®Ά§ïr(sh®Σ)Αl(f®Γ)…ζΈοάμΉÉΜ·�Θ§ΕχΈοάμΉÉΜ·÷–≤Μ“ΜΕ®Αl(f®Γ)…ζΜ·¨W(xu®Π)ΉÉΜ·ΓΘ
(7)≈–îύΖΫΖ®ΘΚΚξ”^ΖΫΟφ «Ζώ”–ΤδΥϊΒΡΈοΌ|(zh®§)…ζ≥…�ΓΘΈΔ”^ΖΫΟφ «Ζώ”––¬Ζ÷Ή”…ζ≥…ΓΘ
(8)“ΤδΥϊΈοΌ|(zh®§)”≤Δ≤Μ «÷ΗΈοΌ|(zh®§)ΒΡ–Έ†νΚΆ†νëB(t®Λi)ΒΡΉÉΜ·���Θ§Εχ «ΫM≥…ΚΆΫY(ji®Π)‰΄(g®Αu)ΒΡΉÉΜ·�ΓΘ
(9)‘ΎΜ·¨W(xu®Π)ΉÉΜ·ïr(sh®Σ)Θ§≥ΘΑικS”–Αl(f®Γ)Ιβ�����ΓΔΑl(f®Γ)üα��ΓΔΉÉ…Ϊ���ΓΔΖ≈≥ωöβσwΓΔ…ζ≥…≥ΝΒμ�����ΓΔ±§’®Β»§F(xi®Λn)œσ�����Θ§Ώ@–©§F(xi®Λn)œσ÷ΜΡήΉςûι≈–îύΒΡίo÷ζ“ά™ΰ(j®¥)�Θ§Εχ≤ΜΡήΉςûι≈–îύΜ·¨W(xu®Π)ΉÉΜ·ΒΡ‰Υ(bi®Γo)€ (zh®≥n)ΓΘ»γüτ≈ίΆ®κäΑl(f®Γ)ΙβΑl(f®Γ)üα�����Θ§üo…ΪΒΡ―θöβ“ΚΜ·ΉÉ≥…Β≠Υ{(l®Δn)…ΪΒΡ“ΚσwΒ»ΕΦ «ΈοάμΉÉΜ·���ΓΘΒΪ «¦]”–§F(xi®Λn)œσ≤Μ“ΜΕ® «¦]Αl(f®Γ)…ζΜ·¨W(xu®Π)ΉÉΜ·����ΓΘ
(10)»γΙϊ÷Μ «†νëB(t®Λi)Μρ–Έ†νΒΡΗΡΉÉΘ§“ΜΑψ «ΈοάμΉÉΜ·�ΓΘ
2ΓΔΈοΌ|(zh®§)–‘Ό|(zh®§)
(1)Έοάμ–‘Ό|(zh®§)Αϋά®ΈοΌ|(zh®§)ΒΡν¹…Ϊ��ΓΔ†νëB(t®Λi)ΓΔöβΈΕ�ΓΔ»έϋc(di®Θn)ΓΔΖ–ϋc(di®Θn)�ΓΔ”≤Ε»���ΓΔΟήΕ»�����ΓΔ»ήΫβ–‘�����ΓΔ™]Αl(f®Γ)–‘��ΓΔΈϋΗΫ–‘Β»ΓΘ
(2)Έοάμ–‘Ό|(zh®§)“≤≤Δ≤Μ «÷Μ”–ΈοΌ|(zh®§)Αl(f®Γ)…ζΈοάμΉÉΜ·ïr(sh®Σ)≤≈±μ§F(xi®Λn)≥ω¹μΒΡ–‘Ό|(zh®§);άΐ»γΘΚΡΨ≤ΡΨΏ”–ΟήΕ»ΒΡ–‘Ό|(zh®§)����Θ§≤Δ≤Μ“Σ«σΤδΗΡΉÉ–Έ†νïr(sh®Σ)≤≈±μ§F(xi®Λn)≥ω¹μΓΘ
(3)Ö^(q®±)Ζ÷Έοάμ–‘Ό|(zh®§)ΚΆΜ·¨W(xu®Π)–‘Ό|(zh®§)ïr(sh®Σ)“ΜΕ®“ΣΉΞΉΓ «Ζώ–η“ΣΑl(f®Γ)…ζΜ·¨W(xu®Π)ΉÉΜ·≤≈Ρή±μ§F(xi®Λn)≥ω¹μ���ΓΘ
Θ®
άϊ”ΟΜ·¨W(xu®Π)–‘Ό|(zh®§)≈cΈοάμ–‘Ό|(zh®§)�Θ§≤ΜÉHΩ…“‘”Ο¹μΆΤîύΈοΌ|(zh®§)ΦΑΤδ”ΟΆΨ�Θ§Εχ«“Ω…“‘ηb³eΨΏσwΒΡΈοΌ|(zh®§)ȧ»».
ΒΎΕΰÜΈ‘Σ’nν}1Ω’öβ
“Μ��ΓΔΩ’öβΘΚ
1���ΓΔΒΎ“Μ²Ä(g®®)ΒΟ≥ωΩ’öβΫM≥…ΒΡΜ·¨W(xu®Π)Φ“ΘΚά≠ΆΏεa(ΒΎ“Μ²Ä(g®®)”ΟΧλΤΫΏM(j®§n)––Ε®ΝΩΖ÷Έω)��ΓΘ
2���ΓΔΩ’öβΒΡ≥…Ζ÷Α¥σwΖeΖ÷?j®Ϊn)?sh®¥)(≤Μ «Ό|(zh®§)ΝΩΖ÷?j®Ϊn)?sh®¥))”΄(j®§)ΥψΘΚΒΣ?d®≤)?8%Θ§―θöβ21%�Θ§œΓ”–öβσw0.94%,CO20.03%Θ§ΤδΥϊöβσwΚΆκsΌ|(zh®§)���ΓΘ
3����ΓΔΩ’öβ «ΜλΚœΈο
4ΓΔΩ’öβΒΡΈέ»ΨΘΚ≈≈Ζ≈ΒΫΩ’öβ÷–ΒΡ”–ΚΠΈοΌ|(zh®§)÷ς“Σ «üüâmΚΆ”–ΚΠöβσw(CO����ΓΔSO2ΓΔΒΣΒΡ―θΜ·Έο)����ΓΘ
5ΓΔΩ’öβΒΡΈέ»Ψ÷ΗîΒ(sh®¥)‘Ϋ¥σ����Θ§Ω’öβΌ|(zh®§)ΝΩΦâ(j®Σ)³e‘ΫΗΏ��Θ§Ω’öβΌ|(zh®§)ΝΩ‘Ϋ≤ν�����ΓΘ
5�ΓΔΩ’öβ÷–”–ΚΠöβσw÷ς“Σ¹μΉ‘Μ· ·»ΦΝœ(ΟΚΚΆ ·”ΆΒ»)ΒΡ»ΦüΐΚΆΙΛèSΒΡèUöβΓΔΤϊή΅≈≈Ζ≈ΒΡΈ≤öβΒ»���ΓΘ
6�ΓΔΕΰ―θΜ·ΧΦ≤Μ «Έέ»ΨΈοΓΘ
7���ΓΔΙΛ‰I(y®®)…œάϊ”ΟΖ÷κx“ΚëB(t®Λi)Ω’öβ÷Τ»Γ―θöβ�����Θ§¥ΥΉÉΜ· «ΈοάμΉÉΜ·��Θ§≤Μ «Ζ÷ΫβΖ¥ëΣ(y®©ng)�ΓΘ
8���ΓΔΒΣ?d®≤)?1)Μ·¨W(xu®Π)–‘Ό|(zh®§)≤Μ÷ß≥÷»Φüΐ��Θ§≤ΜΡή»Φüΐ���Θ§
(2)”ΟΆΨΘΚΩ…Ής±ΘΉo(h®¥)öβΘ§üτ≈ί÷–≥δ»κΩ…―”ιL Ι”ΟâέΟϋ��Θ§ ≥ΤΖΑϋ―bïr(sh®Σ)≥δΒΣ“‘ΖάΗ·�Θ§Ω…Ής÷Τά䳩ΓΘ
9���ΓΔœΓ”–öβσw(1)Μ·¨W(xu®Π)–‘Ό|(zh®§)≤ΜΜνùä����Θ§(2)”ΟΆΨΘΚ≥ΘΉς±ΘΉo(h®¥)öβΘ§üτ≈ί÷–≥δœΓ”–öβσw“‘ Ιüτ≈ίΡΆ”Ο���Θ§Ά®κäïr(sh®Σ)ïΰ(hu®§)Αl(f®Γ)≥ω≤ΜΆ§ν¹…ΪΒΡΙβ��Θ§÷Τ‘λΒΆ€Ί≠h(hu®Δn)Ψ≥����ΓΘ
Εΰ���ΓΔΩ’öβ÷–―θöβΚ§ΝΩΒΡ€yΕ®
(1)¨ç(sh®Σ)ρû(y®Λn)‘≠άμΘΚ”ΟΦtΝΉ»ΦüΐœϊΚΡγä’÷É»(n®®i)ΒΡ―θöβ�����Θ§¨ß(d®Θo)÷¬γä’÷É»(n®®i)âΚèä(qi®Δng)€p–ΓΘ§‘Ύ¥σöβâΚΒΡΉς”Οœ¬���Θ§Υ°ΏM(j®§n)»κΤΩÉ»(n®®i)’Φ™ΰ(j®¥)€p…ΌΒΡ―θöβΥυ’ΦΒΡΩ’ιg����Θ§èΡΕχ€yΕ®Ω’öβ÷–―θöβΒΡσwΖeΖ÷?j®Ϊn)?sh®¥)���ΓΘ
(2)Ζ¥ëΣ(y®©ng) ΫΘΚ4P+O22P2O5
(3)¨ç(sh®Σ)ρû(y®Λn)≤ΫσEΘΚ
ΔΌΏBΫ”―b÷Ο����Θ§≤Δôz≤ι―b÷ΟΒΡöβΟή–‘ΓΘ
ΝΔΦ¥
ΔΎϋc(di®Θn)»Φ»Φüΐ≥ΉÉ»(n®®i)ΒΡΦtΝΉ��Θ§…λ»κΦ·öβΤΩ÷–�����Θ§≤Δ»ϊΉ”�ΓΘ
œ®€γ≤ΔάδÖs
Δέ¥ΐΦtΝΉΚσΘ§è½Μ…äA���ΓΘ
(4)¨ç(sh®Σ)ρû(y®Λn)§F(xi®Λn)œσΘΚΔΌΦtΝΉ»Φüΐ��Θ§°a(ch®Θn)…ζ¥σΝΩΑΉüü;ΔΎΖ≈üα;ΔέάδÖsΚσ¥ρι_è½Μ…äA����Θ§Υ°―Ί÷χ¨ß(d®Θo)ΙήΏM(j®§n)»κΦ·öβΤΩ÷–�Θ§ΏM(j®§n)»κΦ·öβΤΩÉ»(n®®i)Υ°ΒΡσwΖeΦs’ΦΦ·öβΤΩΩ’öβΩ²σwΖeΒΡΈεΖ÷÷°“ΜΓΘ
(5)¨ç(sh®Σ)ρû(y®Λn)ΫY(ji®Π)’™ΘΚΔΌO2Φs’Φ1/5;ΔΎΩ’öβ «ΜλΚœΈο;ΔέN2Φs’Φ4/5���Θ§≤Μ÷ß≥÷»Φüΐ�����Θ§“≤≤ΜΡή»Φüΐ���Θ§κy»ή”ΎΥ°
(6)ΉΔ“β ¬μ½(xi®Λng)ΘΚ
1>�ΓΔΩ…»ΦΈο“Σ«σΘΚ“Ή»Φüΐ�����Θ§ΉψΝΩ«“°a(ch®Θn)Έο «ΙΧσw��ΓΘ
2>�����ΓΔ―b÷Ο“Σ«σΘΚöβΟή–‘ΝΦΚΟ
3>��ΓΔ‘ΎΦ·öβΤΩΒΉΦ”Υ°ΒΡΡΩΒΡΘΚΈϋ ’üαΝΩ�����Θ§Ζά÷Ι±§’®�����ΓΘ
4>���ΓΔ≤ΜΡήΖώ”ΟηF¥ζΧφΦtΝΉΒΡ‘≠“ρΘΚηF≤ΜΡή‘ΎΩ’öβ÷–»Φüΐ
5>����ΓΔ≤ΜΡήΖώ”ΟΧΦ����ΓΔΝρ¥ζΧφΦtΝΉΒΡ‘≠“ρΘΚ“ρ?y®Λn)ιΝρΓΔΡΨΧΩ»Φüΐ…ζ≥…Εΰ―θΜ·Νρ�ΓΔΕΰ―θΜ·ΧΦö(x®§)βσwΘ§ ΙâΚèä(qi®Δng)ΉÉΜ·≤Μ¥σ����ΓΘ
6>ΓΔ≤Μ“Σ”ΟφV¥ζΧφΦtΝΉΒΡ‘≠“ρΘΚφV‘ΎΩ’öβ÷–»Φüΐïr(sh®Σ)Ρή≈cΒΣ?d®≤)βΚΆΕΰ―θΜ·ΧΦΑl(f®Γ)…ζΖ¥ëΣ(y®©ng)���Θ§Ώ@‰”≤ΜÉHœϊΚΡ―θöβ�Θ§ΏÄœϊΚΡΝΥΒΣ?d®≤)βΚΆΕΰ―θΜ·ΧΦΓ?/p>
(7)¨ç(sh®Σ)ρû(y®Λn)’`≤ν
1>�����ΓΔ“ΚΟφ…œ…ΐ–Γ”Ύ1/5‘≠“ρΘΚ
(1)―b÷ΟöβΟή–‘≤ΜΚΟ
(2)ΦtΝΉΒΡΝΩ≤ΜΉψ
(3)―b÷ΟΈ¥άδÖsΨΆ¥ρι_è½Μ…äA
(4)ΤΩÉ»(n®®i)Κ§”–öà”ύΒΡ―θöβ
2>ΓΔ“ΚΟφ…œ…ΐ¥σ”Ύ1/5‘≠“ρΘΚ
(1)‘Ύ»ΦüΐΏ^≥Χ÷–Έ¥äAΨoè½Μ…äA
(2)≤ε»κ»Φüΐ≥ΉΧΪ¬ΐ����Θ§»ϊΨoΤΩ»ϊ÷°«ΑΤΩÉ»(n®®i)≤ΩΖ÷Ω’öβ ήüα“ί≥ω
(8)¨ç(sh®Σ)ρû(y®Λn)ΗΡΏM(j®§n)ΚσΒΡÉû(y®≠u)ϋc(di®Θn):
―b÷Ο ΦΫKΟήΖβΘ§¨ç(sh®Σ)ρû(y®Λn)ΫY(ji®Π)’™Ηϋ€ (zh®≥n)¥_����Θ§±ήΟβΑΉüüîU(ku®Α)…ΔΒΫΩ’öβ÷–Έέ»Ψ≠h(hu®Δn)Ψ≥Θ§Ηϋ≠h(hu®Δn)±Θ�����ΓΘ
»ΐ�����ΓΔ―θöβ
1��ΓΔ―θöβΒΡΫM≥…ΘΚ”…―θ‘ΣΥΊΫM≥…ΒΡÜΈΌ|(zh®§)
2���ΓΔ―θöβΒΡ‰΄(g®Αu)≥…ΘΚ“Μ²Ä(g®®)―θΖ÷Ή””…É…²Ä(g®®)―θ‘≠Ή”‰΄(g®Αu)≥…ΒΡ��Θ§Μρ’Ώ―θöβ «”…―θΖ÷Ή”‰΄(g®Αu)≥…ΒΡ�ΓΘ
3���ΓΔ―θöβΒΡΈοάμ–‘Ό|(zh®§)ΘΚüo…ΪüoΈΕ��Θ§≤Μ“Ή»ή”ΎΥ°�Θ§ΟήΕ»±»Ω’öβΒΡ¬‘¥σ��ΓΘ“Κ―θ�����ΓΔΙΧëB(t®Λi)―θΒ≠Υ{(l®Δn)…Ϊ��ΓΘ
4���ΓΔ―θöβΒΡΜ·¨W(xu®Π)–‘Ό|(zh®§)ΘΚ―θöβ «“ΜΖNΜ·¨W(xu®Π)–‘Ό|(zh®§)±»ί^ΜνùäΒΡöβσw���Θ§ΡήΗζ‘SΕύΈοΌ|(zh®§)Αl(f®Γ)…ζΜ·¨W(xu®Π)Ζ¥ëΣ(y®©ng)Θ§ΨΏ”–―θΜ·–‘�����Θ§Ρή÷ß≥÷»Φüΐ���Θ§”–÷ζ»Φ–‘��ΓΘ
5���ΓΔΡΨΧΩ
1ΓΖ≤ΌΉςΘΚ”ΟέαàεψQäA»Γ“Μ–ΓâKΡΨΧΩ����Θ§‘ΎΨΤΨΪüτ…œΦ”üαΒΫΑl(f®Γ)Φt�Θ§”…ΤΩΩΎœρœ¬Ψè¬ΐ≤ε»κΒΫ Δ”–―θöβΒΡΦ·öβΤΩ÷–(‘≠“ρ «ûιΝΥ±ΘΉC”–≥δΉψΒΡ―θöβ÷ß≥÷ΡΨΧΩ»Φüΐ)
2ΓΖ§F(xi®Λn)œσΘΚ(1)Αl(f®Γ)≥ωΑΉΙβΘ§(2)…ζ≥… Ι ·Μ“Υ°ΉÉ€ÜùαΒΡöβσw
3ΓΖ±μΏ_(d®Δ) ΫΘΚC+O2====CO2
6�����ΓΔΝρ
1ΓΖ§F(xi®Λn)œσΘΚ(1)Νρ‘ΎΩ’öβάο»ΦüΐΑl(f®Γ)≥ωΈΔ»θΒΡΒ≠Υ{(l®Δn)…ΪΜπ―φ��Θ§‘Ύ―θöβάο»ΦüΐΑl(f®Γ)≥ωΥ{(l®Δn)Ήœ…ΪΜπ―φ��Θ§(2)°a(ch®Θn)…ζ”–¥ΧΦΛ–‘öβΈΕΒΡöβσw����ΓΘ
2ΓΖ±μΏ_(d®Δ) ΫΘΚS+ O2====SO2
3ΓΖΉΔ“βϋc(di®Θn)ΘΚνA(y®¥)œ»Ζ≈»κ…ΌΝΩΥ°Μρ…ΌΝΩΒΡöδ―θΜ·βc»ή“ΚΘ§Έϋ ’SO2�Θ§Ζά÷ΙΩ’öβΈέ»Ψ
7ΓΔηFΫz
1ΓΖ¨ç(sh®Σ)ρû(y®Λn)≤ΌΉςΘΚΑ―ΙβΝΝΒΡΦö(x®§)ηFΫz±P≥…¬ί–ΐ†ν��Θ§œ¬ΕΥœΒ“ΜΗυΜπ≤ώ��Θ§ϋc(di®Θn)»ΦΜπ≤ώΘ§¥ΐΜπ≤ώΩλ»Φ±Mïr(sh®Σ)�Θ§”……œœρœ¬Ψè¬ΐ≤ε»κ Δ”–―θöβΒΡΦ·öβΤΩ÷–(ûιΝΥΖά÷ΙΦö(x®§)ηFΫz»Φüΐïr(sh®Σ)Ζ≈üα Ι―θöβèΡΦ·öβΤΩΩΎ“ί≥ωΘ§±ΘΉC”–≥δΉψΒΡ―θöβ≈cΦö(x®§)ηFΫzΖ¥ëΣ(y®©ng))�����ΓΘ
2ΓΖ§F(xi®Λn)œσΘΚ‘Ύ―θöβ÷–»Φüΐ§F(xi®Λn)œσΘΚ(1)³ΓΝ“»Φüΐ�Θ§Μπ–«ΥΡ…δ����Θ§(2)…ζ≥…ΚΎ…ΪΙΧσwΓΘ
3ΓΖ±μΏ_(d®Δ) ΫΘΚ3Fe+2O2====Fe3O4
4ΓΖΉΔ“βΘΚ
ΔΌ”Ο…ΑΦàΑ―Φö(x®§)ηFΫzΡΞ≥…ΙβΝΝΒΡψyΑΉ…Ϊ����Θ§ «ûιΝΥ≥ΐ»ΞΦö(x®§)ηFΫz±μΟφΒΡκsΌ|(zh®§)ΓΘ
ΔΎ¨ΔΦö(x®§)ηFΫz±P≥…¬ί–ΐ†ν����Θ§ «ûιΝΥ‘ω¥σΦö(x®§)ηFΫz≈c―θöβΒΡΫ””|ΟφΖeΓΘΔέΑ―Φö(x®§)ηFΫzά@‘ΎΜπ≤ώ…œ���Θ§ «ûιΝΥ“ΐ»ΦΦö(x®§)ηFΫz���ΓΘ
Δή¥ΐΜπ≤ώΩλ»Φ±Mïr(sh®Σ)≤≈Ψè¬ΐ≤ε»κ Δ”–―θöβΒΡΦ·öβΤΩ÷–����Θ§ «ûιΝΥΖά÷ΙΜπ≤ώ»Φüΐïr(sh®Σ)œϊΚΡ―θöβ�Θ§±ΘΉC”–≥δΉψΒΡ―θöβ≈cΦö(x®§)ηFΫzΖ¥ëΣ(y®©ng)ΓΘ
ΔίΦ·öβΤΩάο“ΣνA(y®¥)œ»―b…ΌΝΩΥ°Μρ‘ΎΤΩΒΉδ¹…œ“Μ±Γ¨”Φö(x®§)…≥��Θ§ «ûιΝΥΖά÷ΙΉΤüαΒΡ…ζ≥…ΈοûR¬δ ΙΦ·öβΤΩΤΩΒΉ’®Ν―�ΓΘ
8ΓΔ―θöβΒΡάϊ±Ή
1�ΓΔ”–ΚΠΒΡΖΫΟφΘΚ ≥ΈοΒΡΗ·îΓΘ§δ™ηF…ζδP;
2���ΓΔ”–άϊΒΡΖΫΟφΘΚα³ΨΤ��Θ§α³¥Ή����Θ§ΚτΈϋΉς”Ο
9�ΓΔ―θöβΒΡ”ΟΆΨ
öβΚΗΓΔΚΫΧλ�ΓΔù™Υ°ΓΔΒ«…Ϋ���ΓΔαt(y®©)·ü���ΓΔ“Κ―θ’®Υé�����ΓΔü£ηF�����ΓΔü£δ™
―θöβ÷Τ»Γ
“ΜΓΔ―θöβΒΡΙΛ‰I(y®®)÷Τ²δ
1���ΓΔΖ÷κx“ΚëB(t®Λi)Ω’öβΖ®(‘≠άμΘΚάϊ”ΟN2����ΓΔO2ΒΡΖ–ϋc(di®Θn)≤ΜΆ§���Θ§N2œ»±Μ’τΑl(f®Γ)��Θ§”ύœ¬ΒΡ «“Κ―θ(ΌA¥φ‘ΎΧλΥ{(l®Δn)…Ϊδ™ΤΩ÷–)(Ώ@ «ΈοάμΉÉΜ·�Θ§≤Μ «Ζ÷ΫβΖ¥ëΣ(y®©ng))
2���ΓΔΡΛΖ÷κxΖ®
Εΰ�����ΓΔ¨ç(sh®Σ)ρû(y®Λn) “÷Τ―θöβ
(“Μ)���ΓΔ‘≠άμ
MnO2
2H2O2=====2H2O+ O2↑
Γς
2KMnO4====K2MnO4+MnO2+ O2↑
MnO2
2KClO3======2KCl+3O2↑
Γς
(Εΰ)�����ΓΔ―b÷Ο
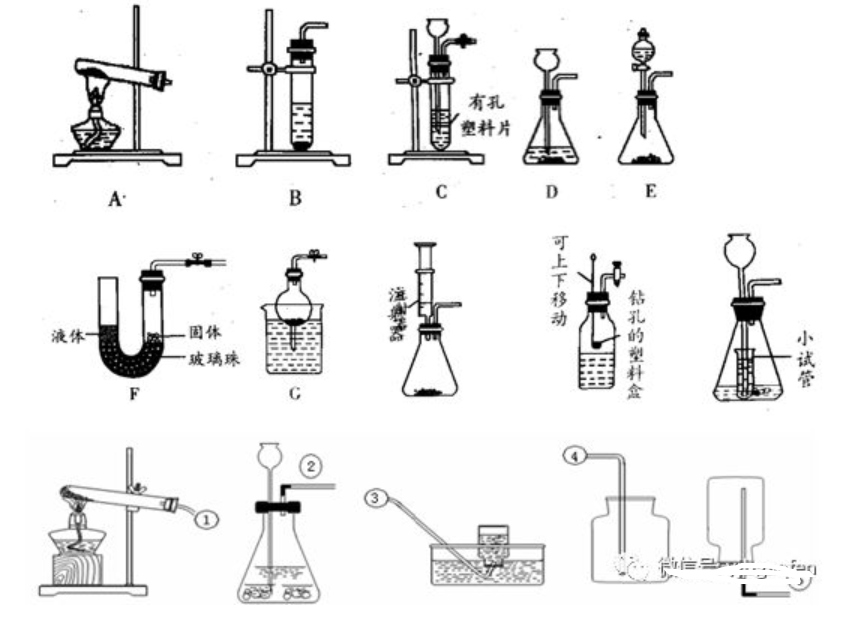
1�����ΓΔΑl(f®Γ)…ζ―b÷ΟΘΚΏx™ώΒΡ“ά™ΰ(j®¥)(Μρ’ΏΩΦë]ΒΡ“ρΥΊ) «Ζ¥ëΣ(y®©ng)ΈοΒΡ†νëB(t®Λi)ΚΆΖ¥ëΣ(y®©ng)½lΦΰ
ΙΧσw���Θ§–ηΦ”üαΘ©
(1)ΙΧΙΧΦ”üα–Ά(Ζ¥ëΣ(y®©ng)Έο «
ΙΧσw≈c“ΚσwΘ§≤Μ–η“ΣΦ”üαΘ©
(2)ΙΧ“Κ≤Μ–ηΦ”üα–Ά(Ζ¥ëΣ(y®©ng)Έο «
2�����ΓΔ ’Φ·―b÷ΟΘΚΏx™ώΒΡ“ά™ΰ(j®¥)(Μρ’ΏΩΦë]ΒΡ“ρΥΊ) «öβσwΒΡΟήΕ»ΚΆ»ήΫβ–‘
(1)ΟήΕ»±»Ω’öβ¥σ”Οœρ…œ≈≈Ω’öβΖ®(Ώ@ΖN ’Φ·ΖΫΖ® ’ΒΫöβσw≤ΜΦÉ��Θ§ΒΪΗ…‘ο)
(2)κy»ήΜρ≤Μ»ή”ΎΥ°”Ο≈≈Υ°Ζ®(Ώ@ΖN ’Φ·ΖΫΖ® ’ΒΫΒΡöβσwΦÉÉτ)
3���ΓΔ―b÷ΟΒΡÉû(y®≠u)ϋc(di®Θn)ΘΚ(1)±ψ”ΎΧμΦ”“Κσw(2)≤ΌΉςΚÜÜΈ(3)ΩΊ÷ΤΖ¥ëΣ(y®©ng)ΥΌ¬ (ΜρΩΊ÷ΤΖ¥ëΣ(y®©ng)ΒΡΑl(f®Γ)…ζΜρΆΘ÷Ι)
4�����ΓΔöβΟή–‘ΒΡôzρû(y®Λn)ΘΚ
A�ΓΔΑ―¨ß(d®Θo)ΙήΒΡ“ΜΕΥΖ≈»κ ΔΥ°ΒΡüΐ±≠÷–Θ§”Ο ÷ΨoΌN»ίΤςΆβ±Ύ�Θ§”^≤λΒΫ¨ß(d®Θo)ΙήΩΎ”–öβ≈ί°a(ch®Θn)…ζΘ§³t―b÷Ο≤Μ¬©öβ��ΓΘ

B����ΓΔεF–ΈΤΩ≈cιLνi¬©ΕΖ
ΖΫΖ®“Μ:Υ…ι_è½Μ…äAΘ§èΡιLνi¬©ΕΖΧéΉΔΥ°, Ι÷°œ¬ΕΥΙήΩΎΫΰ»ΥΥ°÷–��Θ§‘ΌΑ―¨ß(d®Θo)ΙήΖ≈»κ―b”–Υ°ΒΡüΐ±≠÷–�Θ§”ΟÉ… ÷ΨoΌNεF–ΈΤΩΆβ±Ύ��Θ§»γΙϊ¨ß(d®Θo)ΙήΩΎ”–öβ≈ίΟΑ≥ω�����Θ§Ζ≈ι_ ÷Κσ”–…ΌΝΩΥ°ΏM(j®§n)»Υ¨ß(d®Θo)Ιή–Έ≥…“ΜΕΈΥ°÷υ�����Θ§’fΟς―b÷Ο≤Μ¬©öβΓΘ
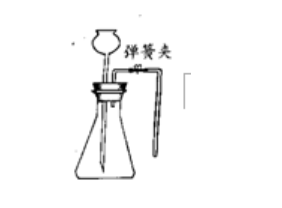
ΖΫΖ®Εΰ:äAΨoè½ΚjäA���Θ§èΡιLνi¬©ΕΖΧéΉΔΥ°, Ι÷°œ¬ΕΥΙήΩΎΫΰ»κΥ°÷–,ά^άm(x®¥)Φ”Υ°–Έ≥…“ΜΕΈΥ°÷υ��Θ§≈cεF–ΈΤΩÉ»(n®®i)“Κσw°a(ch®Θn)…ζ“ΚΟφ≤ν��Θ§«“‘Ύ“ΜΕΈïr(sh®Σ)ιgÉ»(n®®i)Υ°÷υ≤ΜΑl(f®Γ)…ζΜΊ¬δ,’fΟς―b÷Ο≤Μ¬©öβ��ΓΘ
C���ΓΔιLνi¬©ΕΖ≈cΉΔ…δΤςèΡιLνi¬©ΕΖΧéΉΔΥ°Θ§ Ι÷°œ¬ΕΥΙήΩΎΫΰ»ΥΥ°÷–��ΓΘ»τΆυΆβά≠ΉΔ…δΤςΜν»ϊ���Θ§Αl(f®Γ)§F(xi®Λn)ιLνi¬©ΕΖœ¬ΕΥΟΑ≥ωöβ≈ί�Θ§³t―b÷ΟöβΟή–‘ΝΦΚΟ;»τΆυάοΆΤΜν»ϊ����Θ§Αl(f®Γ)§F(xi®Λn)ιLνi¬©ΕΖÉ»(n®®i)–Έ≥…ΕΈΖÄ(w®ßn)Ε®ΒΡΥ°÷υΘ§³t―b÷ΟöβΟή–‘ΝΦΚΟ�����ΓΘ

(»ΐ)ΓΔ≤ΌΉς÷Τ»Γ―θöβΒΡ≤ΌΉς≤ΫσEΚΆΉΔ“βϋc(di®Θn)(“‘ΗΏεiΥαβ¦÷Τ»Γ―θöβ≤Δ”Ο≈≈Υ°Ζ® ’Φ·ûιάΐ)
≤ΫσEΘΚ≤ι―bΕ®ϋc(di®Θn) ’“Τœ®
1�ΓΔΏBΫ”ÉxΤς(èΡœ¬ΒΫ…œΘ§èΡΉσΒΫ”“)
2�ΓΔôzρû(y®Λn)öβΟή–‘
3ΓΔ―bΥéΤΖ
4��ΓΔΙΧΕ®―b÷Ο
5���ΓΔϋc(di®Θn)»Φ
6�ΓΔ ’Φ·öβσw
7�ΓΔ≥Ζκx¨ß(d®Θo)Ιή
8ΓΔœ®€γΨΤΨΪüτ
(ΥΡ)���ΓΔρû(y®Λn)ùMΘΚ
1����ΓΔ»γΙϊ”Οœρ…œ≈≈Ω’öβΖ® ’Φ·��Θ§ρû(y®Λn)ùMΖΫΖ® «”ΟéßΜπ–«ΒΡΡΨ½lΖ≈‘ΎΦ·öβΤΩΩΎ�Θ§ΡΨ½lèΆ(f®¥)»Φ’fΟς“―ùM���ΓΘ
2�����ΓΔ»γΙϊ”Ο≈≈Υ°Ζ® ’Φ·���Θ§ρû(y®Λn)ùMΖΫΖ® «Ω¥ΒΫΥ°≤έ÷–”–öβ≈ί
(Έε)���ΓΔôzρû(y®Λn)ΘΚ”ΟéßΜπ–«ΒΡΡΨ½l…λ»κΦ·öβΤΩÉ»(n®®i)Θ§ΡΨ½lèΆ(f®¥)»Φ’fΟς «―θöβ�ΓΘ
(Νυ)ΓΔΉΔ“β ¬μ½(xi®Λng)
ΔΌ‘΅ΙήΩΎëΣ(y®©ng)¬‘œρœ¬ÉA–±(Ζά÷ΙΥéΤΖ÷–öà¥φΒΡΥ°Ζ÷ ήüαΉÉ≥…Υ°’τöβ���Θ§”ωάδΒΙΝςΜΊ‘΅ΙήΒΉ≤Ω�Θ§ Ι‘΅Ιή’®Ν―���ΓΘ)
ΔΎΥéΤΖΤΫδ¹‘Ύ‘΅ΙήΒΡΒΉ≤Ω(‘ωΦ”ΈοΌ|(zh®§)ΒΡ ήüαΟφΖe��ΓΘ)
ΔέηFäAëΣ(y®©ng)äA‘Ύκx‘΅ΙήΩΎΒΡ1/4~1/3Χé(±ψ”ΎνA(y®¥)üα)
Δή¨ß(d®Θo)ΙήëΣ(y®©ng)…‘¬Ε≥ωœπΤΛ»ϊ(±ψ”Ύöβσw≈≈≥ω)
Δί‘΅ΙήΩΎëΣ(y®©ng)Ζ≈“ΜàF(tu®Δn)ΟόΜ®ΘΚΖά÷ΙΗΏεiΥαβ¦ΖέΡ©ΏM(j®§n)»κ¨ß(d®Θo)Ιή
ΔΏ”Ο≈≈Υ°Ζ® ’Φ·―θöβïr(sh®Σ)����Θ§°î(d®Γng)¨ß(d®Θo)ΙήΩΎ³²°a(ch®Θn)…ζöβ≈ίïr(sh®Σ)≤ΜΡήΝΔΦ¥ ’Φ·�����Θ§¥ΐ¨ß(d®Θo)ΙήΩΎ”–ΏBάm(x®¥)Ψυ³ρΒΡöβ≈ίΟΑ≥ωïr(sh®Σ)‘Ό ’Φ·ΓΘ“ρ?y®Λn)ιι_ Φïr(sh®Σ)≈≈≥ωΒΡöβ≈ίάοΩ’öβ����Θ§»τ¥Υïr(sh®Σ) ’Φ·Θ§³t―θöβ≤ΜΦÉ�����ΓΘ
Δύ»τ”Οœρ…œ≈≈Ω’öβΖ® ’Φ·��Θ§¨ß(d®Θo)Ιή…λΒΫΦ·öβΤΩΒΡΒΉ≤Ω��Θ§±ψ”ΎΩ’öβ≈≈≥ω�����ΓΘ
Δα ’Φ·ùM―θöβΒΡΦ·öβΤΩ“Σ’ΐΖ≈�Θ§ΤΩΩΎΧé…w…œ≤ΘΝßΤ§ΓΘ
Δβ¨ç(sh®Σ)ρû(y®Λn)ΫY(ji®Π) χïr(sh®Σ)�Θ§œ»“Τ¨ß(d®Θo)Ιή‘Όœ®€γΨΤΨΪüτ(Ζά÷ΙΥ°ΒΙΈϋ“ΐΤπ‘΅ΙήΤΤΝ―)
9ΓΔ“‘―θöβûιΚΥ–ΡΒΡόD(zhu®Θn)Μ·ξP(gu®Γn)œΒàD

¥ΏΜ·³©
ΗΡΉÉ
1����ΓΔΕ®ΝxΘΚ÷Η‘ΎΜ·¨W(xu®Π)ΉÉΜ·άοΡήâρΜ·¨W(xu®Π)Ζ¥ëΣ(y®©ng)ΒΡΘ§Εχ±Ψ…μΒΡ‘ΎΖ¥ëΣ(y®©ng)«ΑΚσΕΦ¦]”–Αl(f®Γ)…ζΉÉΜ·ΒΡΈοΌ|(zh®§)Ϋ–Ήω¥ΏΜ·³©;¥ΏΜ·³©‘ΎΜ·¨W(xu®Π)Ζ¥ëΣ(y®©ng)÷–ΒΡΉς”ΟΫ–¥ΏΜ·Ής”Ο���ΓΘ
2�ΓΔ¥ΏΜ·³©Μυ±ΨΧΊ’ς «““ΜΉÉÉ…≤ΜΉÉ”
3��ΓΔ““ΜΉÉ”÷ΗΒΡ «ΗΡΉÉΖ¥ëΣ(y®©ng)ΥΌ¬ ����Θ§“ΗΡΉÉ”Αϋά®“Φ”Ωλ”ΚΆ“€p¬ΐ”
4ΓΔ“Εΰ≤ΜΉÉ”÷ΗΒΡ «Ό|(zh®§)ΝΩΚΆΜ·¨W(xu®Π)–‘Ό|(zh®§)≤ΜΉÉ�����Θ§(≤Μ «–‘Ό|(zh®§)�����Θ§“≤≤Μ «Έοάμ–‘Ό|(zh®§))
5����ΓΔ Ι”Ο¥ΏΜ·³©Ρή ΙΜ·¨W(xu®Π)Ζ¥ëΣ(y®©ng)ΒΡΥΌ¬ ≤Μ“ΜΕ®Φ”ΩλΘ§“≤Ω…Ρή€p¬ΐ
6��ΓΔ Ι”Ο¥ΏΜ·³©≤ΜΡή‘ωΦ”…ζ≥…ΈοΒΡΌ|(zh®§)ΝΩ�����Θ§Εχ…ζ≥…ΈοΒΡΌ|(zh®§)ΝΩ «”…Ζ¥ëΣ(y®©ng)ΈοΒΡΌ|(zh®§)ΝΩ¦QΕ®ΒΡΓΘ
7��ΓΔΕΰ―θΜ·εi≤Μ“ΜΕ® «”ΟΉς»ΈΚΈΖ¥ëΣ(y®©ng)ΒΡ¥ΏΜ·³©
8�����ΓΔ“Μ²Ä(g®®)Ζ¥ëΣ(y®©ng)ΒΡ¥ΏΜ·³©Ω…“‘”–ΕύΖN�ΓΘ¨ç(sh®Σ)ρû(y®Λn) “”ΟΏ^―θΜ·öδ÷Τ―θöβΩ…Ρή”ΟΕΰ―θΜ·εiΩ…ΝρΥαψ~»ή“ΚΉς¥ΏΜ·³©
9ΓΔ¥ΏΜ·³©≤Μ «Μ·¨W(xu®Π)Ζ¥ëΣ(y®©ng)ΒΡ±Ί“Σ½lΦΰ���Θ§Υϋ÷ΜΗΡΉÉΜ·¨W(xu®Π)Ζ¥ëΣ(y®©ng)ΒΡΥΌ¬ �Θ§Εχ≤ΜΡή¦QΕ®ΡήΖώΑl(f®Γ)…ζΜ·¨W(xu®Π)Ζ¥ëΣ(y®©ng)����ΓΘ»γ¦]”–¥ΏΜ·³©Θ§¨ΔΏ^―θΜ·öδΦ”üα“≤ΡήΖ¥ëΣ(y®©ng)Ζ≈≥ω―θöβ���ΓΘ
10��ΓΔ¥ΏΜ·³© «ÖΔΦ”Μ·¨W(xu®Π)Ζ¥ëΣ(y®©ng)ΒΡ���Θ§ΒΪ «Υϋ÷Μ «≈cΖ¥ëΣ(y®©ng)ΈοΖ¥ëΣ(y®©ng)…ζ≥…÷–ιg°a(ch®Θn)Έο�Θ§Ζ¥ëΣ(y®©ng)ΫY(ji®Π) χΚσ�����Θ§”÷Μ÷èΆ(f®¥)ûιœύΆ§Ό|(zh®§)ΝΩΒΡ‘≠ΈοΌ|(zh®§)���Θ§≤Δ¦]”–…ζ≥…ΤδΥϊΈοΌ|(zh®§)Θ§“≤ΨΆ «’f¦]”–…ζ≥…–¬ΈοΌ|(zh®§)����Θ§“ρ¥Υ¥ΏΜ·³©÷ΜΡή «Ζ¥ëΣ(y®©ng)ΒΡ“Μ²Ä(g®®)½lΦΰΘ§Εχ≤ΜΡή «Ζ¥ëΣ(y®©ng)Έο�ΓΘ
11ΓΔ¥ΏΜ·³©‘Ύ Ι”Οïr(sh®Σ)���Θ§≤Δ≤Μ «‘ΫΕύ‘ΫΚΟ��ΓΘ
12�����ΓΔΗΏεiΥαβ¦κmΡήΗΡΉÉ¬»Υαβ¦÷Τ»Γ―θöβΒΡΖ¥ëΣ(y®©ng)ΥΌ¬ �Θ§ΒΪ≤Μ «¥ΏΜ·³©�����Θ§“ρ?y®Λn)ιΥϋΒΡΌ|(zh®§)ΝΩΚΆΜ·¨W(xu®Π)–‘Ό|(zh®§)ΕΦΑl(f®Γ)…ζΝΥΗΡΉÉΓΘ
13���ΓΔ Ι”ΟΏ^ΒΡ¥ΏΜ·³©Ά®Ώ^Ώ^ûV���ΓΔœ¥€λΓΔΗ…‘ο‘ΌΜΊ ’άϊ”Ο
14����ΓΔΧΫΨΩΡ≥ΖNΈοΌ|(zh®§) «≤Μ «“¥ΏΜ·³©”ïr(sh®Σ)Θ§“ΜΕ®“ΣΆ§ïr(sh®Σ)ùMΉψ»ΐ²Ä(g®®)½lΦΰΘΚΦ¥(1)Ζ¥ëΣ(y®©ng)ΥΌ¬ (2)«ΑΚσΌ|(zh®§)ΝΩ(3)«ΑΚσΜ·¨W(xu®Π)–‘Ό|(zh®§)
Ζ¥ëΣ(y®©ng)νê–Ά
(“Μ)Μ·ΚœΖ¥ëΣ(y®©ng)
1��ΓΔΜ·ΚœΖ¥ëΣ(y®©ng)ΘΚΑ―É…ΖNΜρÉ…ΖN“‘…œΈοΌ|(zh®§)…ζ≥…Νμ“ΜΖNΈοΌ|(zh®§)ΒΡΖ¥ëΣ(y®©ng)
2�ΓΔΜ·ΚœΖ¥ëΣ(y®©ng)ΘΚΧΊ’ς «“Εύ”ΉÉ““Μ”ΓΘ
3�����ΓΔ±μ Ψ–Έ ΫΘΚA+B+……→C����ΓΘ
4ΓΔΜ·ΚœΖ¥ëΣ(y®©ng)¨Ό”ΎΜυ±ΨΖ¥ëΣ(y®©ng)νê–Ά÷–ΒΡ“ΜΖNΓΘ
5�ΓΔΖ¥ëΣ(y®©ng)÷–Ης‘ΣΥΊΒΡΜ·ΚœÉr(ji®Λ)≤Μ“ΜΕ®ΗΡΉÉΓΘ
6��ΓΔΖ¥ëΣ(y®©ng)Έο≤Μ“ΜΕ®”–ÜΈΌ|(zh®§)��Θ§…ζ≥…Έο“ΜΕ® «Μ·ΚœΈο��ΓΘ
(Εΰ)Ζ÷ΫβΖ¥ëΣ(y®©ng)
1�����ΓΔΕ®ΝxΘΚ”…“ΜΖNΖ¥ëΣ(y®©ng)Έο…ζ≥…É…ΖNΜρÉ…ΖN“‘…œΤδΥϊΈοΌ|(zh®§)ΒΡΖ¥ëΣ(y®©ng)
2�ΓΔΧΊ’ς «““Μ”ΉÉ“Εύ”�����ΓΘ
3���ΓΔ±μ Ψ–Έ ΫΘΚA→B+C+……
4����ΓΔ¨Ό”Ύ «Μυ±ΨΖ¥ëΣ(y®©ng)νê–Ά÷–ΒΡ“ΜΖN�����Θ§
5ΓΔΖ¥ëΣ(y®©ng)«ΑΚσ��Θ§Ης‘ΣΥΊΜ·ΚœÉr(ji®Λ)≤Μ“ΜΕ®ΗΡΉÉ�����ΓΘ
6����ΓΔΖ¥ëΣ(y®©ng)Έο“ΜΕ® «Μ·ΚœΈοΘ§…ζ≥…Έο÷–≤Μ“ΜΕ®”–ÜΈΌ|(zh®§)��ΓΘ
(»ΐ)―θΜ·Ζ¥ëΣ(y®©ng)
1���ΓΔ―θΜ·Ζ¥ëΣ(y®©ng)ΘΚΈοΌ|(zh®§)≈c―θ÷°ιgΒΡΖ¥ëΣ(y®©ng);
2�ΓΔΏ@άοΒΡ“―θ”≤ΜΡή™Q≥…“―θöβ”���Θ§“ρ?y®Λn)ι―θΦ»Αϋά®ÜΈΌ|(zh®§)―θöβ����Θ§”÷Αϋά®Μ·ΚœΈο÷–ΒΡ―θ���ΓΘ
3�ΓΔ”–―θöβÖΔΦ”ΒΡΖ¥ëΣ(y®©ng)“ΜΕ® «―θΜ·Ζ¥ëΣ(y®©ng)
4ΓΔ―θΜ·Ζ¥ëΣ(y®©ng)≤Μ“ΜΕ®”–―θöβÖΔΦ”
5�ΓΔ―θΜ·Ζ¥ëΣ(y®©ng)≤Μ¨Ό”ΎΜυ±ΨΖ¥ëΣ(y®©ng)νê–ΆΓΘ
Ψéί΄ΆΤΥ]ΘΚ
2024Ρξ÷–ΩΦΗςΩΤΡΩ÷Ίϋc(di®Θn)÷ΣΉR(sh®Σ)ÖRΩ²
ΓΓΓΓΉν–¬÷–ΩΦΌY”ç���ΓΔ÷–ΩΦ’ΰ≤Ώ�ΓΔΩΦ«Α€ (zh®≥n)²δ���ΓΔ÷–ΩΦνA(y®¥)€y�ΓΔ䦻ΓΖ÷?j®Ϊn)?sh®¥)ΨÄΒ»
ΓΓΓΓ÷–ΩΦïr(sh®Σ)ιgΨÄΒΡ»Ϊ≤Ω÷Ί“ΣΙù(ji®Π)ϋc(di®Θn)
ΓΓΓΓ±M‘Ύ"÷–ΩΦΨW(w®Θng)"ΈΔ–≈ΙΪ±äΧ•(h®Λo)

ΓΓΓΓ ög”≠ Ι”Ο ÷ôC(j®©)�����ΓΔΤΫΑεΒ»“Τ³”(d®Αng)‘O(sh®®)²δ‘LÜ•÷–ΩΦΨW(w®Θng)���Θ§2024÷–ΩΦ“Μ¬Ζ≈ψΑιΆ§––ΘΓ>>ϋc(di®Θn)™τ≤ιΩ¥















